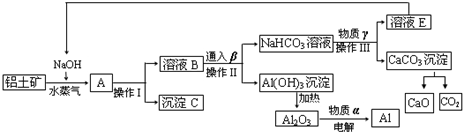
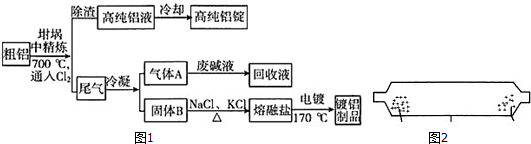
题目内容
17.实验室为完成某一实验,需用240mL0.1mol/L的稀盐酸,现用11.8mol/L的浓盐酸配制,填空并请回答下列问题:(1)配制完成某一实验所需0.1mol/L的盐酸溶液,选用250mL容量瓶,应量取浓盐酸体积为2.1mL,除容量瓶外还需要的其它仪器有10ml量筒、烧杯、玻璃棒、胶头滴管等.
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)B、C、A、F、E、D.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量 水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响):没有进行A操作偏低;加蒸馏水时不慎超过了刻度偏低;定容时俯视偏高.
(4)1.06gNa2CO3与足量所配制的盐酸反应,生成CO2气体在标准状况下的体积是0.224升.需所配制的盐酸的体积至少为200毫升才为足量.
分析 (1)依据配制溶液体积选择容量瓶规格,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓盐酸的体积;配制溶液的实验操作步骤选择需要仪器;
(2)依据配制一定物质的量浓度溶液一般步骤排序;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对溶液浓度的影响;
(4)根据n=$\frac{m}{M}$,计算1.06gNa2CO3的物质的量,根据C原子守恒计算CO2的物质的量,根据V=nVm计算二氧化碳的体积.
解答 解:(1)配制240mL 1mol•L-1的稀盐酸,应选择250mL容量瓶,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设需要钠元素的体积为V,则:
0.1mol/L×250mL=11.8mol/L×V,
解得:V=2.1mL;
配制一定物质的量浓度溶液一般步骤为:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管、胶头滴管;
故答案为:250;2.1;10mL量筒;烧杯;玻璃棒;胶头滴管;
(2)配制一定物质的量浓度溶液一般步骤为:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶等,所以正确的顺序为:B、C、A、F、E、D;
故答案为:B、C、A、F、E、D;
(3)没有进行A操作,导致,部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
加蒸馏水时不慎超过了刻度,导致溶液体积偏大,溶液浓度偏低;
定容时俯视,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏低;偏低;偏高;
(4)1.06gNa2CO3的物质的量为$\frac{1.06g}{106g/mol}$mol=0.01mol,盐酸足量,碳酸钠完全反应,根据C原子守恒可知,生成二氧化碳的物质的量为0.01mol,故二氧化碳的体积为0.01mol×22.4L/mol=0.224L,
二氧化碳的物质的量为0.01mol,至少消耗0.02mol盐酸,需要0.1mol/L的稀盐酸200mL,
故答案为:0.224;200.
点评 本题考查一定物质的量浓度溶液的配制、根据方程式的计算等,明确配制原理及操作步骤是解题关键,注意误差分析的方法好技巧,题目难度不大.

①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥锦纶织品.
| A. | ①②③ | B. | ②④ | C. | ③④⑤ | D. | ③④⑥ |
①道尔顿提出的原子论;②卢瑟福的原子结构行星模型;
③玻尔的原子轨道模型;④汤姆生提出的葡萄干面包原子模型.
| A. | ①④②③ | B. | ③①④② | C. | ③②①④ | D. | ③①②④ |
| A. | 标况下,11.2L的SO3含有1.5NA个氧原子 | |
| B. | NA个CO2的质量为44g•mol-1 | |
| C. | 0.5mol•L-1CuCl2溶液中含Cl-数为NA | |
| D. | 1L1 mol•L-1 Na2CO3溶液中所含阴离子数目一定大于NA |