题目内容
4.如图是一套制取并验证氯气部分化学性质的实验装置.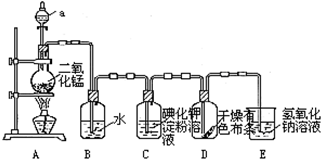
回答下列问题:
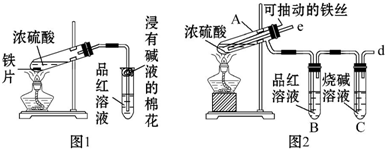
(1)装置A中,仪器a的名称叫分液漏斗,该仪器中盛有的试剂为_浓盐酸.
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值<7(填“>”“<”或“=”)
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为蓝色,反应的离子方程式为Cl2+2I-=I2+2Cl-.
(4)写出装置A中发生反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(5)装置E的作用是吸收多余的Cl2.
(6)若要制取标准状况下2.24L的Cl2,需要MnO2的质量为?8.7g.但用含有0.4mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于2.24L的原因是浓盐酸变稀后反应停止,0.4molHCl不能完全反应,因此生成的氯气体积(标准状况下)总是小于2.24L.
分析 (1)分析仪器形状及用途说出其名称;装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应;
(2)氯气溶于水,部分与水反应生成盐酸和次氯酸;
(3)氯气氧化性强于碘,能够置换单质碘,碘遇到淀粉变蓝;
(4)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气和水;
(5)氯气有毒,直接排放能够引起空气污染,氯气能够与碱反应,需要用氢氧化钠溶液吸收;
(6)依据MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O计算解答,注意二氧化锰只能与浓盐酸反应,与稀盐酸不反应.
解答 解:(1)依据仪器形状可知,图中仪器a为分液漏斗;装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应;
故答案为:分液漏斗;浓盐酸;
(2)氯气溶于水,部分与水反应生成盐酸和次氯酸,盐酸和次氯酸电离产生氢离子,使溶液中氢离子浓度大于氢氧根离子浓度,溶液显酸性pH<7;
故答案为:<;
(3)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质,反应离子方程式为:Cl2+2I -=2Cl-+I2,碘单质遇到淀粉变蓝;
故答案为:蓝色;Cl2+2I -=2Cl-+I2;
(4)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(5)氯气有毒,直接排放能够引起空气污染,氯气能够与碱反应,需要用氢氧化钠溶液吸收,
故答案为:吸收多余的Cl2;
(6)n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
87g 1mol
m 0.1mol
m=8.7g,
所以理论上需要8.7gMnO2参加反应;
浓盐酸还原性较强,在加热条件下可与二氧化锰发生氧化还原反应,但随着反应的进行,盐酸浓度逐渐降低,还原性减弱,浓盐酸变稀后反应停止,0.4molHCl不能完全反应,因此生成的氯气体积(标准状况下)总 是小于2.24L;
故答案为:8.7;浓盐酸变稀后反应停止,0.4molHCl不能完全反应,因此生成的氯气体积(标准状况下)总 是小于2.24L.
点评 本题考查了氯气的实验室制法及其性质,侧重于学生的分析、实验能力的考查,明确氯气的实验室制备原理及氯气的性质是解题关键,注意盐酸与二氧化锰反应条件,题目难度中等.

步骤1:准确称取该晶体0.9820g,配成溶液,平均分成10份.
步骤2:取一份溶液,酸化,加热,用SnCl2-TiCl3将Fe3+全部还原为Fe2+,再加0.0100mol•L-1KMnO4至恰好反应,将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+,消耗KMnO4体积28.00mL.
步骤3:另取一份溶液,酸化,加入0.0100mol•L-1KMnO4至恰好反应完全,将C2O42-全部氧化成CO2,消耗KMnO4体积24.00mL.
(已知:MnO${\;}_{4}^{-}$还原产物为Mn2+,上述实验数据为多次实验有效数据平均值)
下列判断正确的是( )
| A. | 取溶解后待测液少许,先加少量氯水,再加KSCN产生血红色溶液,则有Fe2+ | |
| B. | 步骤3的离子方程式为:5C2O42-+2MnO${\;}_{4}^{-}$+8H2O=10CO2↑+2Mn2++16OH- | |
| C. | x:z=1:2 | |
| D. | 该晶体的化学式为:K3[Fe(C2O4)3]•3H2O |
| A. | ①>②>③>④>⑤ | B. | ②>①>⑤>④>③ | C. | ③>④>⑤>①>② | D. | ⑤>④>③>②>① |
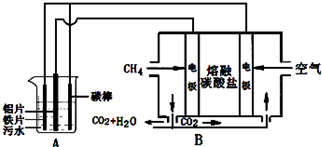
| A. | 装置A中碳棒为阴极 | |
| B. | 污水中加入适量的硫酸钠,可增强溶液的导电性 | |
| C. | 装置B中通入空气的电极反应是O2+2H2O+4e-=4OH- | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
| A. | NaHS在水中的电离方程式为:NaHS═Na++H++S2- | |
| B. | 已知某温度下Ksp(CH3COOAg)=2.8×10-3,此温度下浓度均为0.1 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 | |
| C. | 0.1mol/L CH3COOH溶液与0.05mol/L NaOH溶液等体积混合,所得溶液中:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| D. | 0.2mol/LNH3•H2O溶液与0.1mol/L盐酸等体积混合后,溶液显碱性,则:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| A. | 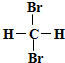 和 和 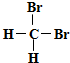 是同一物质 是同一物质 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种. | |
| C. | 某有机物化学式为C3H6O2,其核磁共振氢谱有三个峰,其强度比为3:2:1,则该有机物的结构简式一定是CH3CH2COOH | |
| D. | 在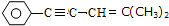 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 |
| A. | 用惰性电极电解MgCl2 溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-73kJ/mol | |
| C. | 将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-═Al2S3↓ | |
| D. | 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 |
| A. | 应密封保存 | |
| B. | 完全燃烧的反应属于复分解反应 | |
| C. | 可用作燃料 | |
| D. | 其中氮元素与氢元素的质量比为14:1 |