题目内容
将AlCl3溶液和NaOH溶液等体积混合,所得沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则原AlCl3溶液和NaOH溶液物质的量浓度之比可能是( )
①2:3 ②1:2 ③3:10 ④2:7.
①2:3 ②1:2 ③3:10 ④2:7.
| A、①② | B、②③ | C、①④ | D、③ |
考点:镁、铝的重要化合物,化学方程式的有关计算
专题:几种重要的金属及其化合物
分析:将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量是所得溶液中铝元素的质量的2倍,沉淀为Al(OH)3,溶液中的铝可能为AlCl3或NaAlO2,
可分别发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
可分别发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
解答:
解:设AlCl3和NaOH的浓度分别为c1和c2,相同体积为V,
①若NaOH稍多一些,生成部分NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,则完全沉淀消耗NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,又因为得到的沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则根据铝守恒,说明有
的氢氧化铝溶解生成偏铝酸根剩余
氢氧化铝沉淀,发生Al(OH)3+OH-=AlO2-+2H2O反应,所以根据反应则又消耗了
c1Vmol的氢氧化钠,所以一共消耗的NaOH的物质的量为:3c1V+
c1V=
c1V=c2V,所以c1:c2=3:10;
②当氯化铝过量时,氢氧化钠不足,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则2(c1V-x)=x,所以x=
c1V,消耗氢氧化钠3x,即2c1Vmol,所以2c1V=c2V,所以此时c1:c2=1:2,所以原AlCl3溶液和NaOH溶液物质的量浓度之比可能是3:10或者1:2;故选:B.
①若NaOH稍多一些,生成部分NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,则完全沉淀消耗NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,又因为得到的沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则根据铝守恒,说明有
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 10 |
| 3 |
②当氯化铝过量时,氢氧化钠不足,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则2(c1V-x)=x,所以x=
| 2 |
| 3 |
点评:本题考查了根据方程式进行计算,同时考查学生分析问题、解决问题能力,很多同学往往只考虑溶液中的铝元素为铝离子而漏掉为偏铝酸根离子而导致错误,为易错点.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
下列关于过氧化钠的叙述正确的是( )
| A、过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 |
| B、可用Na2O2除去N2中的水蒸气 |
| C、过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂 |
| D、过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
一定条件下发生反应 2KClO3+I2═2KIO3+Cl2↑,由此可推断,下列相应结论不正确的是( )
| A、I2具有氧化性 |
| B、该反应属于氧化还原反应 |
| C、氧化剂是KClO3 |
| D、I2是还原剂 |
在明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液,当硫酸根离子恰好完全沉淀时,铝元素的存在形式为( )
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:下列说法中错误的是( )
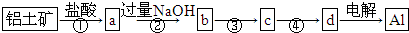
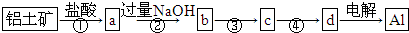
| A、①②中除加试剂外,还需要进行过滤操作 |
| B、a、b中铝元素的化合价不相同 |
| C、③中需要通入过量的CO2 |
| D、④进行的操作是加热,而且d一定是氧化铝 |
室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则下列说法(或关系式)正确的是( )
| A、混合溶液中由水电离出的c(H+)=1×10-5mol/L |
| B、c(A-)+c(HA)=2c(Na+)=0.4 mol/L |
| C、c(HA)>c(A-)>c(Na+)>c(H+)>c (OH-) |
| D、c(A-)-c(HA)=2c(H+)-2 c(OH-) |
 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.