题目内容
 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.(1)快中子反应堆的热交换剂用的是钠钾合金,其常温下是
(2)镁铝合金是经常见到的轻质合金,剪一块合金在空气中燃烧,除生成MgO和Al2O3外,最有可能生成的第三种物质的化学式是
(3)①有一种铜的合金即黄铜(可看作是Cu和Zn),可分别用酸溶法或碱溶法来分离该两种金属,其中把该合金投入到稀盐酸中,发现产生气泡的速度比用锌与盐酸反应制氢气的速度快,其原因是
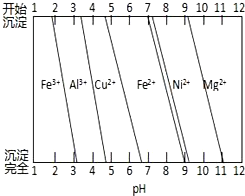
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀.结合如图信息推断该合金中除铜外一定含有
考点:镁、铝的重要化合物,难溶电解质的溶解平衡及沉淀转化的本质
专题:几种重要的金属及其化合物
分析:(1)钠钾合金的熔点低,其常温下为液态;钠和钾反应后都为+1价;
(2)空气中有氮气,镁能与氮气燃烧;酸碱恰好中和时生成沉淀的质量最大;据镁铝的质量和共失去的电子列式计算;
(3)①Cu和Zn合金在稀盐酸中形成原电池反应;
②+2价铁会氧化为+3价铁,会在3.4前出现沉淀,pH=3.4时开始出现沉淀为Al(OH)3,pH=8.0时过滤沉淀为Ni(OH)2,因此该铜合金中还含Al、Ni.
(2)空气中有氮气,镁能与氮气燃烧;酸碱恰好中和时生成沉淀的质量最大;据镁铝的质量和共失去的电子列式计算;
(3)①Cu和Zn合金在稀盐酸中形成原电池反应;
②+2价铁会氧化为+3价铁,会在3.4前出现沉淀,pH=3.4时开始出现沉淀为Al(OH)3,pH=8.0时过滤沉淀为Ni(OH)2,因此该铜合金中还含Al、Ni.
解答:
解:(1)钠钾合金的熔点低,其常温下为液态;据得失电子守恒知:0.2mol钠钾合金反应失去0.2mol电子,故产生D2气体物质的量为0.1mol,所含的中子物质的量为0.1mol×2=0.2mol,中子数为0.2NA;
故答案为:液;0.2NA
(2)空气中有氮气,镁能与氮气燃烧,生成Mg3N2;
因酸碱恰好中和时生成沉淀的质量最大,
设加入的氢氧化钠溶液的体积为V,
则0.2L×3.6mol?L-1×2=V×1mol?L-1,
解得V=1.44L=1440mL,
设镁物质的量为xmol,铝物质的量为ymol,
Mg~2e- Al~3e-
xmol 2xmol ymol 3ymol
得关系式为:
解得:x=0.1mol y=0.1mol
Mg的物质的量分数为:
×100%=50%,
故答案为:Mg3N2;1440;50%;
(3)①Cu和Zn合金在稀盐酸中形成原电池反应,加快反应速率,故答案为:铜锌合金可以形成原电池,加快化学反应速率.
②+2价铁会氧化为+3价铁,会在3.4前出现沉淀,由图可知,结合题中信息可知开始出现沉淀为Al(OH)3、pH=8.0时过滤沉淀Ni(OH)2,因此该铜合金中还含Al、Ni,故答案为:Al、Ni.
故答案为:液;0.2NA
(2)空气中有氮气,镁能与氮气燃烧,生成Mg3N2;
因酸碱恰好中和时生成沉淀的质量最大,
设加入的氢氧化钠溶液的体积为V,
则0.2L×3.6mol?L-1×2=V×1mol?L-1,
解得V=1.44L=1440mL,
设镁物质的量为xmol,铝物质的量为ymol,
Mg~2e- Al~3e-
xmol 2xmol ymol 3ymol
得关系式为:
|
解得:x=0.1mol y=0.1mol
Mg的物质的量分数为:
| 0.1mol |
| 0.1mol+0.1mol |
故答案为:Mg3N2;1440;50%;
(3)①Cu和Zn合金在稀盐酸中形成原电池反应,加快反应速率,故答案为:铜锌合金可以形成原电池,加快化学反应速率.
②+2价铁会氧化为+3价铁,会在3.4前出现沉淀,由图可知,结合题中信息可知开始出现沉淀为Al(OH)3、pH=8.0时过滤沉淀Ni(OH)2,因此该铜合金中还含Al、Ni,故答案为:Al、Ni.
点评:本题考查学生微观粒子、利用金属与酸反应进行计算,原电池的原理,明确酸碱恰好中和时沉淀质量最大及氢氧化铝能溶于强碱时解答本题的关键.

练习册系列答案
相关题目
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
| A、大理石雕像被酸雨腐蚀毁坏 |
| B、充有氢气的气球遇明火爆炸 |
| C、铁制菜刀生锈 |
| D、铜铸塑像上出现铜绿[Cu2 (OH)2CO3] |
将AlCl3溶液和NaOH溶液等体积混合,所得沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则原AlCl3溶液和NaOH溶液物质的量浓度之比可能是( )
①2:3 ②1:2 ③3:10 ④2:7.
①2:3 ②1:2 ③3:10 ④2:7.
| A、①② | B、②③ | C、①④ | D、③ |
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是( )
A、 |
B、 |
C、 |
D、 |
一定条件下,在体积为10L的密闭容器中,2mol X和2mol Y进行如下反应:2X(g)+Y(g)?Z(g),经2min达到平衡,生成0.6mol Z.下列说法正确的是( )
| A、以X浓度变化表示的反应速率为0.06mol/(L?min) | ||
B、将容器体积变为20L,Z的平衡浓度为原来的
| ||
| C、平衡时,X的转化率为30% | ||
| D、起始状态和平衡时容器内的气体压强比为2:1 |

 Ⅰ.化学课上老师演示了如图的实验:
Ⅰ.化学课上老师演示了如图的实验: