题目内容
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:下列说法中错误的是( )


| A、①②中除加试剂外,还需要进行过滤操作 |
| B、a、b中铝元素的化合价不相同 |
| C、③中需要通入过量的CO2 |
| D、④进行的操作是加热,而且d一定是氧化铝 |
考点:镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:几种重要的金属及其化合物
分析:铝土矿加盐酸生成Al3+和Fe3+,二氧化硅不溶于盐酸,所以要过滤,分离出二氧化硅;滤液中加过量NaOH,Al3+转化为AlO2-和Fe3+转化为Fe(OH)3沉淀,过滤除去Fe(OH)3沉淀,向滤液中通过量的二氧化碳,会生成Al(OH)3沉淀,Al(OH)3分解生成Al2O3,最后电解熔融的Al2O3生成Al.
解答:
解:铝土矿加盐酸生成Al3+和Fe3+,二氧化硅不溶于盐酸,所以要过滤,分离出二氧化硅;滤液中加过量NaOH,Al3+转化为AlO2-和Fe3+转化为Fe(OH)3沉淀,过滤除去Fe(OH)3沉淀,向滤液中通过量的二氧化碳,会生成Al(OH)3沉淀,Al(OH)3分解生成Al2O3,最后电解熔融的Al2O3生成Al;
A、由以上分析可知①、②中除加试剂外,还需要进行过滤操作,故A正确;
B、a中为Al3+,b中为AlO2-,a、b中铝元素的化合价均为+3价,故B错误;
C、③中需要把AlO2-转化为Al(OH)3沉淀,要通入过量的二氧化碳,AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C正确;
D、根据上面分析可知④是Al(OH)3受热分解生成Al2O3,故D正确.
故选:B.
A、由以上分析可知①、②中除加试剂外,还需要进行过滤操作,故A正确;
B、a中为Al3+,b中为AlO2-,a、b中铝元素的化合价均为+3价,故B错误;
C、③中需要把AlO2-转化为Al(OH)3沉淀,要通入过量的二氧化碳,AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C正确;
D、根据上面分析可知④是Al(OH)3受热分解生成Al2O3,故D正确.
故选:B.
点评:本题考查了铝土矿中提取Al的工艺流程,注意除杂试剂的选择和物质的分离方法,同时涉及了铝的化合物的性质,题目难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )
| A、CH3COONa |
| B、Na2SO4 |
| C、NH4Cl |
| D、CH3COOH |
向含有1mol明矾的溶液中逐滴加入Ba(OH)2溶液,充分反应,下列说法不正确的是( )
| A、当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5mol |
| B、当SO42-恰好完全沉淀时,Al3+全部转化为AlO2- |
| C、随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
| D、当向溶液中加入1.5mol Ba(OH)2时,反应可用离子方程式2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓表示 |
将AlCl3溶液和NaOH溶液等体积混合,所得沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则原AlCl3溶液和NaOH溶液物质的量浓度之比可能是( )
①2:3 ②1:2 ③3:10 ④2:7.
①2:3 ②1:2 ③3:10 ④2:7.
| A、①② | B、②③ | C、①④ | D、③ |
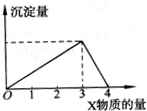 将X气体(或溶液)慢慢通入(或加入)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加入)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为Al2(SO4)3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |
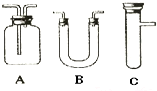 浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C
浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C