题目内容
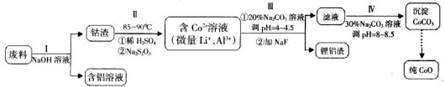
我国钴资源相对比较贫乏,某研究小组以一种含锂、铝和钴的新型电子材料的废料为原料回收金属钴,设计了如下实验方案:已知:该废料中铝以金属铝箔的形式存在;钴以Co2O3?CoO的形式存在,吸附在铝箔的单面或双面;微量的锂混杂于其中.请回答下列问题:
(1)已知60Co原子中含有33个中子,试写出基态钴原子的核外电子排布式:
(2)第Ⅱ步骤操作中在钴渣中加入稀硫酸,再加入Na2S2O3溶液可将钴渣溶解,请完成该过程的离子方程式:
2- 3 |
2- 4 |
(3)为确保产品的纯度,步骤Ⅳ过滤后还需对CoCO3沉淀进行洗涤,简述洗涤过程的操作方法:
(4)锂铝渣的主要成分是Al(OH)3和LiF,步骤Ⅲ和Ⅳ中均用到碳酸钠溶液,则碳酸钠溶液在这两个步骤中所起的主要作用分别是
(5)废料中Co2O3?CoO的含量为96.4%,处理1吨上述废料,理论上可以得到纯CoO
考点:金属的回收与环境、资源保护
专题:实验设计题
分析:制备流程为:废料用碱液溶解,过滤得到偏铝酸钠溶液和钴渣;用硫酸溶解钴渣,发生反应:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,得到含有钴离子的溶液,然后调节溶液pH并用碳酸钠溶液除去杂质铝离子,得到较纯净的含有钴离子的溶液,再加入碳酸钠、调节溶液的pH将钴离子转化成碳酸钴沉淀,最后灼烧碳酸钴得到氧化钴,
(1)Co核外有27个电子,其基态钴原子的核外电子排布式:[Ar]3d74s2;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,(3)洗涤CoCO3沉淀的方法为:沿玻璃棒向漏斗中加蒸馏水浸没沉淀,让水自然流下,重复操作2→3次;
(4)碳酸钠溶液在步骤Ⅲ中主要是消耗H+调节pH值;碳酸钠溶液在步骤Ⅳ中主要是沉淀Co2+,生成CoCO3沉淀;
(5)根据关系式:Co2O3?CoO→3CoO计算.
(1)Co核外有27个电子,其基态钴原子的核外电子排布式:[Ar]3d74s2;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,(3)洗涤CoCO3沉淀的方法为:沿玻璃棒向漏斗中加蒸馏水浸没沉淀,让水自然流下,重复操作2→3次;
(4)碳酸钠溶液在步骤Ⅲ中主要是消耗H+调节pH值;碳酸钠溶液在步骤Ⅳ中主要是沉淀Co2+,生成CoCO3沉淀;
(5)根据关系式:Co2O3?CoO→3CoO计算.
解答:
解:制备氧化钴的大致流程为:制备流程为:废料用碱液溶解,过滤得到偏铝酸钠溶液和钴渣;用硫酸溶解钴渣,发生反应:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,得到含有钴离子的溶液,然后调节溶液pH并用碳酸钠溶液除去杂质铝离子,得到较纯净的含有钴离子的溶液,再加入碳酸钠、调节溶液的pH将钴离子转化成碳酸钴沉淀,最后灼烧碳酸钴得到氧化钴,
(1)Co核外有27个电子,其基态钴原子的核外电子排布式:[Ar]3d74s2;
故答案为:[Ar]3d74s2;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,离子方程式为4Co3O4+S2O32-+22H+=12Co2++2SO42-+11H2O,
故答案为:4Co3O4+S2O32-+22H+=12Co2++2SO42-+11H2O;
(3)洗涤CoCO3沉淀的方法为:沿玻璃棒向漏斗中加蒸馏水浸没沉淀,让水自然流下,重复操作2→3次;
故答案为:沿玻璃棒向漏斗中加蒸馏水浸没沉淀,让水自然流下,重复操作2→3次;
(4)碳酸钠溶液在步骤Ⅲ中主要是消耗H+调节pH值;碳酸钠溶液在步骤Ⅳ中主要是沉淀Co2+,生成CoCO3沉淀;
故答案为:步骤Ⅲ中主要是消耗H+调节pH值;步骤Ⅳ中主要是沉淀Co2+;
(5)根据关系式:Co2O3?CoO→3CoO计算,1吨上述废料,理论上可以得到纯CoO:1t×96.4%×
=0.9t;
故答案为:0.9t.
(1)Co核外有27个电子,其基态钴原子的核外电子排布式:[Ar]3d74s2;
故答案为:[Ar]3d74s2;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,离子方程式为4Co3O4+S2O32-+22H+=12Co2++2SO42-+11H2O,
故答案为:4Co3O4+S2O32-+22H+=12Co2++2SO42-+11H2O;
(3)洗涤CoCO3沉淀的方法为:沿玻璃棒向漏斗中加蒸馏水浸没沉淀,让水自然流下,重复操作2→3次;
故答案为:沿玻璃棒向漏斗中加蒸馏水浸没沉淀,让水自然流下,重复操作2→3次;
(4)碳酸钠溶液在步骤Ⅲ中主要是消耗H+调节pH值;碳酸钠溶液在步骤Ⅳ中主要是沉淀Co2+,生成CoCO3沉淀;
故答案为:步骤Ⅲ中主要是消耗H+调节pH值;步骤Ⅳ中主要是沉淀Co2+;
(5)根据关系式:Co2O3?CoO→3CoO计算,1吨上述废料,理论上可以得到纯CoO:1t×96.4%×
| 225 |
| 241 |
故答案为:0.9t.
点评:本题考查了金属及其化合物的性质,考查氧化还原反应、离子反应、关系式计算等,题目难度中等,解答关键根据实验流程利用氧化还原反应判断发生的离子反应,侧重对学生综合能力的考查,是一道质量较好的能力考查题.

练习册系列答案
相关题目
实验室加热氯酸钾与MnO2的混合物制氧气,从剩余物中回收MnO2操作顺序正确的是( )
| A、溶解、过滤、蒸发、结晶 |
| B、溶解、洗涤、过滤、干燥 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、过滤、洗涤、干燥 |
常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 盐酸和20.00mL 0.1000mol?L-1醋酸溶液,得到两条滴定曲线,如图所示,若以HA表示酸,下列说法正确的是( )
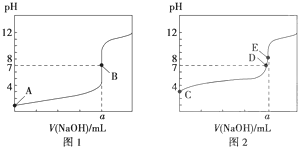

| A、滴定盐酸的曲线是图2 |
| B、达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
| C、达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-) |
| D、当0mL<V(NaOH)<20.00mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-) |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述正确的是( )


| A、贝诺酯分子中所有碳原子一定共平面 |
| B、可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C、贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
| D、乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
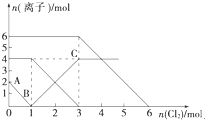 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3 mol |
| C、当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
下列有关物质性质的应用正确的是( )
| A、氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 |
| B、碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污 |
| C、氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 |
| D、铜的金属性比铁弱,可将海轮浸水部分镶上铜锭以减缓船体腐蚀 |
为了检验SO42-,甲、乙、丙、丁四位同学设计了如下4种方案,其中方案最优的是( )
A、方案甲:试液
| ||||
B、方案乙:试液
| ||||
C、方案丙:试液
| ||||
D、方案丁:试液
|