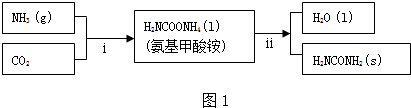
题目内容
7.在一定温度下,有:a.醋酸 b.硫酸 c.盐酸三种酸:①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是a>c>b(用a、b、c表示,下同).
②将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是a>b=c.
分析 ①酸或碱抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大;
②盐酸和硫酸是强酸,醋酸是弱酸,c(H+)相同的三种酸均加水稀释至原来的100倍后,醋酸继续电离,HCl和硫酸完全电离.
解答 解:①酸或碱抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大,b、c是强酸而a是弱酸,物质的量相同时c(H+):b>c>a,则抑制水电离程度b>c>a,所以三种溶液中水的电离程度由大到小a>c>b,
故答案为:a>c>b;
②盐酸和硫酸是强酸,醋酸是弱酸,c(H+)相同的三种酸均加水稀释至原来的100倍后,醋酸继续电离,HCl和硫酸完全电离,所以c(H+)由大到小顺序是a>b=c,
故答案为:a>b=c.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点及氢离子浓度与水电离程度关系是解本题关键,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
15.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
2.下列有关食品添加剂的说法中正确的是( )
| A. | 在限量范围内使用不会对人体造成危害 | |
| B. | 只有不法商贩才使用食品添加剂 | |
| C. | 不使用食品添加剂的纯天然食品最安全 | |
| D. | 食品添加剂就是为食品好卖出 |
19.下列叙述正确的是( )
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 向水中加入少量稀硫酸,c(H+)增大,KW不变 | |
| C. | 向水中加入氨水,水的电离平衡向正反应方向移动,c(OH-)增大 | |
| D. | pH=3的醋酸溶液,稀释至10倍后pH=4 |
16.下列对能量转化的认知中,正确的是( )
| A. | 电解水生成H2和O2时,化学能主要转化为电能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,热能主要转化为化学能 | |
| D. | 白炽灯工作时,只发生电能转化为光能 |