题目内容
15.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
分析 A、根据c=$\frac{1000ρω}{M}$计算该硫酸溶液的物质的量浓度;
B.根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析;
C、硫酸是强电解质;
D、根据密度和体积计算溶液的总质量,根据硫酸的密度大于水的密度,判断质量分数关系;
解答 解:A、该硫酸溶液的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B、发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,故生成二氧化硫的物质的量小于0.05L×18.4mol/L×0.5×22.4L/mol=10.4L,故B错误;
C、硫酸是强酸是强电解质,故C正确;
D、等体积混合,设体积分别为Vml,98%的H2SO4溶液密度为ρ1,水密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=$\frac{V•ρ1×98%}{V•ρ1+V•ρ2}$×100%=$\frac{ρ1×98%}{ρ1+ρ2}$×100%,因硫酸的密度大于水的密度,则ρ1>ρ2,所以=$\frac{ρ1×98%}{ρ1+ρ2}$×100%>49%,故D错误;
故选C.
点评 本题考查溶液浓度有关计算,题目难度中等,注意硫酸的浓度越大密度越大,B选项为易错点,注意浓度的影响.

练习册系列答案
相关题目
10.某温度下,在一个2L的密闭容器中,加入4mol A和2mol B进行如下反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
| A. | 增加C,B的平衡转化率不变 | |
| B. | 此时,B的平衡转化率是35% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |
20.不溶于水且比水轻的一组液体是( )
| A. | 甲苯、四氯化碳 | B. | 苯、汽油 | C. | 硝基苯、一氯丙烷 | D. | 酒精、溴 |
4.如图所示装置,密闭容器内分别充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )

| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
5.合理利用某些盐能水解的性质,能解决许多生产、生活中的问题.下列有关对盐水解性质的利用描述中不正确的是( )
| A. | 洗涤油污常用热的碳酸钠溶液 | |
| B. | 无法利用Na2S溶液和AlCl3溶液制备Al2S3 | |
| C. | 金属焊接中,可用NH4Cl溶液作除锈剂 | |
| D. | 工业上用FeCl3溶液腐蚀铜制印刷电路板 |
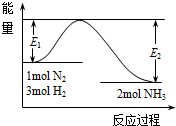 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.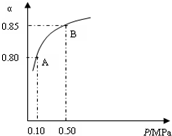 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.