题目内容
19.下列叙述正确的是( )| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 向水中加入少量稀硫酸,c(H+)增大,KW不变 | |
| C. | 向水中加入氨水,水的电离平衡向正反应方向移动,c(OH-)增大 | |
| D. | pH=3的醋酸溶液,稀释至10倍后pH=4 |
分析 A.无论pH大小,纯水都呈中性;
B.水中加入稀硫酸,c(H+)增大,离子积常数只与温度有关;
C.向水中加入氨水,c(OH-)增大,抑制水电离;
D.醋酸是弱电解质,醋酸溶液中存在电离平衡.
解答 解:A.无论pH大小,纯水都呈中性,95℃纯水的pH<7,但纯水仍然呈中性,故A错误;
B.水中加入稀硫酸,c(H+)增大,离子积常数只与温度有关,温度不变,水的离子积常数不变,故B正确;
C.向水中加入氨水,c(OH-)增大,抑制水电离,水的电离平衡逆向移动,故C错误;
D.醋酸是弱电解质,醋酸溶液中存在电离平衡,所以pH=3的醋酸溶液,稀释至10倍后溶液中氢离子浓度大于原来的$\frac{1}{10}$,所以稀释有溶液的pH<4,故D错误;
故选B.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点、水电离影响因素是解本题关键,注意:离子积常数只与温度有关,与溶液酸碱性及物质溶解性强弱无关,易错选项是A.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
9.下列有关热化学方程式的叙述正确的是( )
| A. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3 kJ | |
| B. | 已知正丁烷(g)→异丁烷(g)△H<0,则正丁烷比异丁烷稳定 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
10.某温度下,在一个2L的密闭容器中,加入4mol A和2mol B进行如下反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
| A. | 增加C,B的平衡转化率不变 | |
| B. | 此时,B的平衡转化率是35% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |
14.下列反应中,水只作氧化剂的是( )
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | Na2O+H2O═2NaOH | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
4.如图所示装置,密闭容器内分别充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )

| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
11.下列物质①氯乙烷和氯乙烯;②硝基乙烷[C2H5NO2]和甘氨酸[NH2CH2COOH];③溴乙烷和1,2-二溴乙烷;④二甲苯和苯乙烯;⑤2戊烯和环戊烷,互为同分异构体的是( )
| A. | ①② | B. | ②③④ | C. | ①③⑤ | D. | ②⑤ |
8.在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中“溴酸盐( BrO3-)”这一潜在致癌物质被做了严格限制.有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐.下列有关该转化过程的认识正确的是( )
| A. | 1 molBr-完全转化为BrO3-,得到6 mol电子 | |
| B. | 该过程中溴化物发生氧化反应,臭氧发生还原反应 | |
| C. | 该过程中溴元素被还原,氧元素被氧化 | |
| D. | 该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 |
6.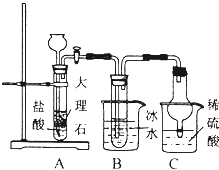 氨气是重要的化工原料.
氨气是重要的化工原料.
(1)实验室可用浓氨水和abd(选填编号)快速制取氨气.
a.烧碱 b.生石灰 c.氯化铵d.碱石灰
(2)“侯氏制碱”的核心反应为:
NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3.依据此原理,欲制得碳酸氢钠晶体,某同学设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和.
①C装置的作用为防倒吸、吸收过量氨气防污染.
②如表列出的是相关物质在不同温度下的溶解度数据(g/100g水):
参照表中数据,请分析B装置中使用冰水的目的是低温便于析出碳酸氢钠.
③该同学在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液的洗气装置,其作用除去二氧化碳气体中的氯化氢气体.
④若该同学进行实验时,所用饱和食盐水中含NaCl的质量为11.7g,实验后得到干燥的NaHCO3晶体的质量为10.92g,则NaHCO3的产率为65%.
(3)往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深蓝色,有[Cu(NH3)4]2+生成.往溶液中滴加稀硫酸,溶液变为淡蓝色.颜色变浅的原因除溶液变稀外,还可能存在平衡I:[Cu(NH3)4]2+ (深蓝色)+4H+?Cu2+(蓝色)+4NH4+
请设计一个简单实验证明平衡I是否存在往深蓝色溶液中通入少量HCl气体若溶液颜色变浅,证明有平衡Ⅰ的存在,否则不存在(或通入少量氨气或加少量NaOH固体,若溶液颜色变深证明平衡Ⅰ的存在,否则不存在).
 氨气是重要的化工原料.
氨气是重要的化工原料.(1)实验室可用浓氨水和abd(选填编号)快速制取氨气.
a.烧碱 b.生石灰 c.氯化铵d.碱石灰
(2)“侯氏制碱”的核心反应为:
NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3.依据此原理,欲制得碳酸氢钠晶体,某同学设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和.
①C装置的作用为防倒吸、吸收过量氨气防污染.
②如表列出的是相关物质在不同温度下的溶解度数据(g/100g水):
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
③该同学在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液的洗气装置,其作用除去二氧化碳气体中的氯化氢气体.
④若该同学进行实验时,所用饱和食盐水中含NaCl的质量为11.7g,实验后得到干燥的NaHCO3晶体的质量为10.92g,则NaHCO3的产率为65%.
(3)往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深蓝色,有[Cu(NH3)4]2+生成.往溶液中滴加稀硫酸,溶液变为淡蓝色.颜色变浅的原因除溶液变稀外,还可能存在平衡I:[Cu(NH3)4]2+ (深蓝色)+4H+?Cu2+(蓝色)+4NH4+
请设计一个简单实验证明平衡I是否存在往深蓝色溶液中通入少量HCl气体若溶液颜色变浅,证明有平衡Ⅰ的存在,否则不存在(或通入少量氨气或加少量NaOH固体,若溶液颜色变深证明平衡Ⅰ的存在,否则不存在).