题目内容
17.加热N2O5,依次发生的分解反应为①N2O5?N2O3+O2,②N2O3?N2O+O2;在1L密闭容器中充入4mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5mol/L,N2O3的平衡浓度为1.7mol/L.则t℃时N2O的平衡浓度为1.4mol/L.分析 N2O5?N2O3+O2,反应中生成 N2O3物质的量为x,O2 物质的量为x,反应N2O3?N2O+O2 中生成N2O物质的量为y,O2 物质的量为y,测得达平衡时O2为4.5mol,N2O3 为1.7mol,则x+y=4.5,x-y=1.7
计算得到x=3.1mol,y=1.4mol,据此分析计算.
解答 解:N2O5?N2O3+O2,反应中生成 N2O3物质的量为x,O2 物质的量为x,反应N2O3?N2O+O2 中生成N2O物质的量为y,O2 物质的量为y,测得达平衡时O2为4.5mol,N2O3 为1.7mol,则x+y=4.5,x-y=1.7
计算得到x=3.1mol,y=1.4mol,
平衡时N2O为1.4mol,则t℃时N2O的平衡浓度为1.4mol/L,
故答案为:1.4mol/L.
点评 本题考查了化学平衡计算应用,注意反应过程分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
2.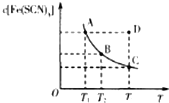 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A. | A点与B点相比,A点的血红色沉淀更多 | |
| B. | 加入KCl固体可以使溶液由D点变到C点 | |
| C. | 反应处于D点时,一定有V(正)<V(逆) | |
| D. | 若T1、T2温度下的平衡常数分别为K1、K2,K1<K2 |
9.下列有关热化学方程式的叙述正确的是( )
| A. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3 kJ | |
| B. | 已知正丁烷(g)→异丁烷(g)△H<0,则正丁烷比异丁烷稳定 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |

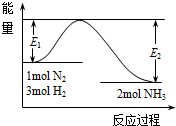 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.