题目内容
18.合成高分子材料PC的反应如图所示,下列说法不正确的是( )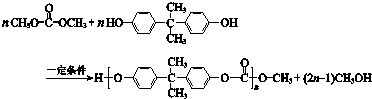
| A. | PC含有酯基 | |
| B. | 合成PC的反应为缩聚反应 | |
| C. | 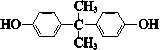 与 与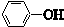 互为同系物 互为同系物 | |
| D. | 1 mol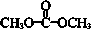 最多能与2 mol NaOH完全反应 最多能与2 mol NaOH完全反应 |
分析 A.根据图知,PC中含有酯基;
B.该反应生成高分子化合物同时还生成甲醇;
C.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物;
D.该物质水解生成碳酸和甲醇.
解答 解:A.根据图知,PC中含有酯基,故A正确;
B.该反应生成高分子化合物同时还生成甲醇,为缩聚反应,故B正确;
C.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物,前者含有两个苯环、两个酚羟基,所以与苯酚不是同系物,故C错误;
D.该物质水解生成碳酸和甲醇,1mol该物质能水解生成1mol碳酸,所以1 mol 最多能与2 mol NaOH完全反应,故D正确;
最多能与2 mol NaOH完全反应,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查基本概念、物质结构,易错选项是D, 由碳酸和甲醇生成,题目难度不大.
由碳酸和甲醇生成,题目难度不大.

练习册系列答案
相关题目
8. 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液可能显中性或酸性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
6.下列说法正确的是( )
| A. | 用浓硝酸与Cu反应制NO2 | B. | 实验室用NH4Cl和Ca(OH)2制备NH3 | ||
| C. | NO2溶于水时发生氧化还原反应 | D. | 过量的铜与浓硝酸反应有N0生成 |
13. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二:全部是Fe3O4;
假设三:是FeO和Fe3O4的混合物.
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
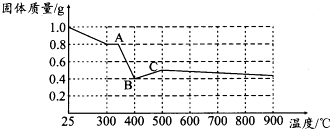
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示.写出加热到400℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:FeC2O4•2H2O═FeO+CO2↑+CO↑+2H2O↑.
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二:全部是Fe3O4;
假设三:是FeO和Fe3O4的混合物.
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |
3.现有溶质为Ba(0H)2、AlCl3、NH4HCO3和H2SO4的四瓶无标签溶液,分别取其中三种溶液于三支试管中,再依次向三支试管中滴加少许剩下的另一种溶液,并稍加热,则下列说法中错误的是( )
| A. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是AlCl3溶液 | |
| B. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是H2SO4 | |
| C. | 若两支试管中都只产生白色沉淀时,则滴加的是Ba(0H)2溶液 | |
| D. | 若两支试管中既产生沉淀又出现气体时,则滴加的是NH4HCO3溶液 |
10.a、b、c、d、e均为短周期主族元素,原子序数依次增大,且原子核外L电子层的电子数分别为0、1、5、8、8,d的最高正价与最低负价的绝对值相等,e的最高价氧化物对应的水化物的化学式为HneO2n+2.下列说法正确的是( )
| A. | 单质的沸点:e>d | |
| B. | 原子半径:r(e)>r(d) | |
| C. | 最高价氧化物对应水化物的酸性:c<d | |
| D. | a、b可以形成离子化合物 |
9.将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.得到如表中的两组数据:
下列说法不正确的是( )
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=1.6,y=0.2,t<6 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v (SO2)=0.2 mol•L-1•min-1 |
10.某混合物含有氯化钠、氯化钾和碳酸钠.经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为( )
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |