题目内容
4.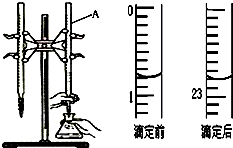 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如下表所示. 根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100 mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
(5)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏高
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
分析 (1)根据仪器的结构来分析;
(2)根据滴定管的结构与精确度为0.01mL;
(3)先根据数据的有效性,然后求出平均消耗V(NaOH),根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$计算;
(4)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$来判断不当操作对相关物理量的影响.
解答 解:(1)该滴定管的下端是玻璃活塞,所以仪器的名称为酸式滴定管,
故答案为:酸式滴定管;
(2)滴定前,滴定管中的液面读数为0.80mL,滴定后,滴定管中的液面读数为22.80mL,
故答案为:0.80;22.80;
(3)三次滴定消耗的体积为:22.02mL,22.00mL,21.98mL,数据均有效,则平均消耗V(NaOH)=22.00mL,c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$=
$\frac{0.1000mol/L×22.00mL}{20.00mL}$=0.1100mol•L-1,
故答案为:0.1100;
(4)滴定时,当溶液颜色由粉红色变为无色,且半分钟内不变色,可说明达到滴定终点,
故答案为:当溶液颜色由粉红色变为无色,且半分钟内不变色;
(5)①若滴定前锥形瓶未用待测液润洗,待测液的物质的量不变,标准液的体积也不变,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,测定结果无影响;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,导致标准液的体积偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,测定结果偏高;
③标准液读数时,若滴定前仰视,滴定后俯视,导致标准液的体积偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,测定结果偏低;
故答案为:无影响;偏高;偏低.
点评 本题考查酸碱中和滴定,明确中和滴定实验的仪器、步骤、终点的判定、数据处理等即可解答,注意滴定管的读数为易错点.

 习题精选系列答案
习题精选系列答案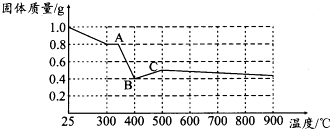 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二:全部是Fe3O4;
假设三:是FeO和Fe3O4的混合物.
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |
| A. | 单质的沸点:e>d | |
| B. | 原子半径:r(e)>r(d) | |
| C. | 最高价氧化物对应水化物的酸性:c<d | |
| D. | a、b可以形成离子化合物 |
| A. | 乙醇 | B. | 1-丙醇 | ||
| C. | 2,2-二甲基-1-丙醇 | D. | 1-丁醇 |
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=1.6,y=0.2,t<6 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v (SO2)=0.2 mol•L-1•min-1 |
| A. | C0和H2混合物lmol.完全燃烧消耗O2的分子数为0.5NA | |
| B. | lmolCnH2n+2 所含的共用电子对数为(3n+l)NA | |
| C. | 标准状况下,22.4L甲醇所含的分子数目为NA | |
| D. | 高温下,33.6g Fe与足量水蒸气反应,生成的H2分子数目为0.8NA |
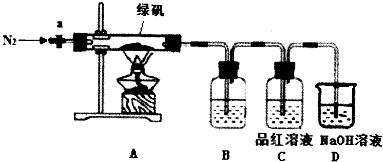
 ,D原子的价层电子排布式为3s23p3.
,D原子的价层电子排布式为3s23p3.

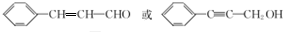 .
. (填结构简式).
(填结构简式).