题目内容
4.下列关于气体摩尔体积的叙述中正确的是( )| A. | 1mol二氧化碳在标准状况时所占的体积约是22.4L | |
| B. | 氧气在标准状况下頕有体积约为22.4L | |
| C. | 1mol任何物质在0℃,1.01×105Pa时体积都约是22.4L | |
| D. | 1mol任何气体的体积都约是22.4L |
分析 标况下,气体摩尔体积为22.4L/mol,根据V=nVm确定气体体积大小.
解答 解:A.依据V=nVm,可知1mol二氧化碳在标准状况时所占的体积约是1mol×22.4L/mol=22.4L,故A正确;
B.氧气物质的量未知,无法计算标况下体积,故B错误;
C.气体摩尔体积只适用与气体,故C错误;
D.气体状况未知,Vm不确定,无法计算1mol气体的体积,故D错误;
故选:A.
点评 本题考查了气体体积的计算,根据公式来分析解答即可,注意气体摩尔体积受温度和压强影响,题目难度不大.

练习册系列答案
相关题目
10.关于如图所示原电池装置的叙述,正确的是( )
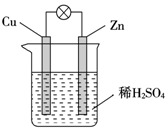

| A. | 电子从铜片经外电路流向锌 | B. | Zn为负极,Cu为正极 | ||
| C. | H+在铜片上得电子发生氧化反应 | D. | 该装置能将电能转化为化学能 |
8.下列说法中正确的是( )
| A. | Na2S2O3 (aq)+2HCl(aq)=2NaCl(aq)+S(s)+SO2(g)+H2O(l)在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反 应方向移动 | |
| B. | 若在恒容容器中发生反应:N2(g)+3H2(g)?2NH3 (g),达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率一时间图象可用图一表示 | |
| D. | 若在恒压容器中发生反应:2SO3 (g)?2SO2 (g)+O2 (g),达到平衡后再充人适量He,其速率一时间图象可用图二表示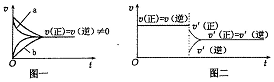 |
15.社会上一些不法分子以铜锌合金(金黄色,俗称黄铜)假冒黄金进行诈骗活动.为了鉴别黄铜和黄金,以下方法不可行的是( )
| A. | 滴一滴硝酸在币的表面,观察现象 | B. | 测硬度 | ||
| C. | 放入稀硫酸,观察现象 | D. | 用手掂轻重 |
9.Na3N是一种离子化合物,它与水反应有NH3生成,以下关于Na3N的叙述正确的是( )
| A. | Na+与N3-的电子层结构都与氩原子相同 | |
| B. | Na3N中的Na+的半径大于N3-的半径 | |
| C. | Na3N与盐酸反应可生成两种盐 | |
| D. | Na3N与水的反应属于氧化还原反应 |
16.下列离子方程式的书写正确的是( )
| A. | 铁跟稀盐酸反应2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸氢钙溶液中加入盐酸Ca(HCO3)2+2HCl═CaCl2+H2O+CO2↑ | |
| C. | CO2通入足量石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | NaHCO3溶液中加入盐酸HCO3-+H+═H2CO3 |
13.NaNO2+NH4Cl═NaCl+N2+2H2O.下列关于该反应的说法中,正确的是( )
| A. | NH4Cl中的N元素被还原 | |
| B. | 生成1 mol N2时转移的电子数为6 mol | |
| C. | NaNO2是氧化剂 | |
| D. | N2既是氧化剂又是还原剂 |
14.下列有关NaClO和NaCl混合溶液的叙述正确的是( )
| A. | 该溶液中,H+、NH4+、Ag+可以大量共存 | |
| B. | 向该溶液中通入CO2,不发生化学反应 | |
| C. | 该溶液可作游泳池及环境的消毒剂,有效成分是NaCl | |
| D. | 常温下,将氯气通入NaOH溶液中可以得到该溶液 |