题目内容
5.水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.(1)写出与H2O分子互为等电子体的一种阴离子的化学式为NH2-.
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+).下列对上述过程的描述不合理的是A
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)向CuSO4溶液中滴加氨水,先产生蓝色沉淀,然后沉淀溶解,溶液呈深蓝色.请写出生成配合离子的离子方程式:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
分析 (1)具有相同价电子数和相同原子数的分子或离子是等电子体;
(2)A.根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,水中氧的杂化为sp3,H3O+中氧的杂化为sp3;
B.水分子为V型,H3O+为三角锥型;
C.分子和离子的化学性质不同;
D.根据微粒的空间构型判断;
(3)硫酸铜和氨水反应生成铵根离子和氢氧化铜沉淀,氢氧化铜沉淀可以溶于过量的氨水中,氢氧化铜和氨水继续反应生成铜氨络合物.
解答 解:(1)H2O有3个原子8个价电子,根据等电子体原理可知,与水互为等电子体的阴离子为NH2-,
故答案为:NH2-;
(2)A.水分子中O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以采用sp3杂化,H3O+中氧原子价层电子对个数=3+$\frac{1}{2}$×(6-1-3×1)=4,杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
B.水分子中O原子含有2个孤电子对,所以O原子采用sp3杂化,其空间构型为V形结构;H3O+为三角锥型,则微粒的形状发生了改变,故B正确;
C.H2O为中性分子,H3O+为酸性的阳离子,微粒的化学性质发生了改变,故C正确;
D.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D正确;
故答案为:A;
(3)向CuSO4的水溶液中逐滴加入氨水,离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2H2O,生成氢氧化铜沉淀,氢氧化铜和氨水继续反应生成铜氨络合物,离子方程式为Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
点评 本题考查物质结构与性质,明确等电子体的概念、杂化轨道理论的应用、空间构型、配位键等知识即可解答,题目难度中等,侧重于基础知识的综合应用的考查.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | MgCl2 | B. | Na2O2 | C. | SiC | D. | H2O |
| A. | 利用油脂在酸性条件下水解,可以生产甘油和肥皂 | |
| B. | 合成纤维和人造纤维统称化学纤维 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 淀粉、蛋白质和油脂都属于高分子化合物 |
| A. | 配制盐酸用量筒量取盐酸时俯视刻度线 | |
| B. | 配制盐酸定容时,仰视容量瓶刻度线 | |
| C. | 称量20gNaOH来配制0.5 mol•L-1 NaOH溶液1000 mL 时,砝码错放在左盘 | |
| D. | NaOH溶解后未经冷却即注入容量瓶至刻度线 |
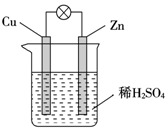
| A. | 电子从铜片经外电路流向锌 | B. | Zn为负极,Cu为正极 | ||
| C. | H+在铜片上得电子发生氧化反应 | D. | 该装置能将电能转化为化学能 |
| A. | 自然界中的金属都是以化合态形式存在的 | |
| B. | 金属活动性虽然不同,但冶炼方法是相同的 | |
| C. | 金属矿物资源丰富且可再生,可尽量开采利用 | |
| D. | 金属的冶炼就是把金属化合物还原为金属单质 |
| A. | 滴一滴硝酸在币的表面,观察现象 | B. | 测硬度 | ||
| C. | 放入稀硫酸,观察现象 | D. | 用手掂轻重 |
