题目内容
1.下列实验操作、实验现象和实验结论均正确的是( )| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向酸性KMnO4溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有还原性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加 KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大 量共存 |
| D | 向10mL 0.1mol•L-1 Na2S溶液中滴入2mL 0.1mol•L-1 ZnSO4溶液,再加入 2mL 0.1mol•L-1 CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性高锰酸钾溶液具有强氧化性,能氧化还原性物质;
B.酸性条件下,亚铁离子能被硝酸根离子氧化生成铁离子,铁离子能和KSCN溶液反应生成血红色溶液;
C.银离子和一水合氨反应生成沉淀,沉淀能和一水合氨反应生成银氨络合物;
D.Na2S溶液过量,均发生沉淀.
解答 解:A.酸性高锰酸钾溶液具有强氧化性,能氧化还原性物质,向酸性KMnO4溶液中滴加乙二酸,溶液褪色,说明高锰酸钾溶液被乙二酸还原,则乙二酸体现还原性,故A正确;
B.酸性条件下,亚铁离子能被硝酸根离子氧化生成铁离子,铁离子能和KSCN溶液反应生成血红色溶液,导致溶液变红色,该实验中体现稀硝酸的强氧化性而不是稀硫酸的强氧化性,故B错误;
C.银离子和一水合氨反应生成沉淀,沉淀能和一水合氨反应生成银氨络合物,所以溶液先生成沉淀后沉淀溶解,所以Ag+与NH3•H2O不能大量共存,故C错误;
D.Na2S溶液过量,均发生沉淀,所以有白色、黑色沉淀生成,但不能说明Ksp(CuS)<Ksp(ZnS),故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,涉及氧化还原反应、络合反应、离子共存及溶度积大小比较,易错选项是D,题目难度中等.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
12.下列有水参加的反应中,不属于盐类水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | |
| B. | Al3++3H2O?Al(OH)3+3H+ | |
| C. | CH3COO-+NH4++H2O?CH3COOH+NH3•H2O | |
| D. | HCO3-+H2O?H3O++CO32- |
9.向恒容密闭容器中投入一定量W气体,发生如下反应:4W(g)?Q(g)+xM(g),在一定条件下反应达到了平衡状态,再投入1 mol W(g)在相同条件下达到第二次平衡.下列有关W转化率的推断正确的是( )
| A. | 若x=4,则W的转化率增大 | B. | 若x=3,则W的转化率不变 | ||
| C. | 若W的转化率增大,则x一定等于1 | D. | 缺条件,无法判断 |
6.将如图所示实验装置的K闭合,下列判断不正确的是( )
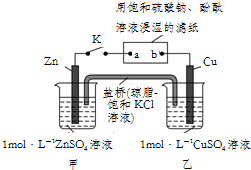

| A. | 盐桥中的Cl-向甲池移动,滤纸上的SO42-向b移动 | |
| B. | 电子流动沿Zn→a,b→Cu的路径 | |
| C. | Cu电极上的反应为:Cu2++2e-═Cu,滤纸a点发生还原反应 | |
| D. | 片刻后,甲池中c(Zn2+)增大,可观察到滤纸b点变红色 |
13.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| C. | 20ml 0.1mol/L CH3COONa溶液与10ml HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
10.某小组同学在实验室中研究+2和+3价铁的硝酸盐的化学性质.
(1)他们测硝酸亚铁溶液的pH常温下小于7,用离子方程式解释其原因是Fe2++2H2O?Fe(OH)2+2H+
(2)甲同学欲配制硝酸亚铁溶液,为防止水解,称量一定量硝酸亚铁晶体溶于pH=1的稀硝
酸中,溶液呈深棕色,液面上方有红棕色气体,放置一段时间,溶液最终呈黄色.
(已知:Fe2+能与NO结合形成深棕色的[Fe(NO)]2+:Fe2++NO?〔Fe(NO)]2+)
①液面上方红棕色气体是NO2
②经检验黄色溶液中有Fe3+.检验Fe3+的操作是取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色
(3)甲同学继续用所得溶液进行实验.
①步骤i溶液中反应的离子方程式是2NO3-+3SO2+2H2O=3SO42-+2NO↑+4H+
②甲认为由步骤i的现象得出SO2与NO3-发生了反应,没有与Fe3+发生反应,请判断甲的结论是否正确并说明原因:正确.溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+
③步骤ii溶液变为浅绿色,反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
④该实验得出的结论是SO2的还原性比Fe2+的强等
(1)他们测硝酸亚铁溶液的pH常温下小于7,用离子方程式解释其原因是Fe2++2H2O?Fe(OH)2+2H+
(2)甲同学欲配制硝酸亚铁溶液,为防止水解,称量一定量硝酸亚铁晶体溶于pH=1的稀硝
酸中,溶液呈深棕色,液面上方有红棕色气体,放置一段时间,溶液最终呈黄色.
(已知:Fe2+能与NO结合形成深棕色的[Fe(NO)]2+:Fe2++NO?〔Fe(NO)]2+)
①液面上方红棕色气体是NO2
②经检验黄色溶液中有Fe3+.检验Fe3+的操作是取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色
(3)甲同学继续用所得溶液进行实验.
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段时间后,溶液变为浅绿色 |
②甲认为由步骤i的现象得出SO2与NO3-发生了反应,没有与Fe3+发生反应,请判断甲的结论是否正确并说明原因:正确.溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+
③步骤ii溶液变为浅绿色,反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
④该实验得出的结论是SO2的还原性比Fe2+的强等
11.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 活泼非金属单质在氧化还原反应中只作氧化剂 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 含有某元素最高价态的化合物不一定具有强氧化性 |




 .
. .
. .
.