题目内容
有反应4HCl+O2→2Cl2+2H2O,已知2molO2被还原时,放出a kJ的热量,且知断开1mol
O2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量.则断开1mol H-O键比断开1molH-Cl 键所需能量高( )
O2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量.则断开1mol H-O键比断开1molH-Cl 键所需能量高( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:设H-Cl键的键能为XkJ/mol,H-O键的键能为YkJ/mol,然后根据反应热=反应物的总键能-生成物的总键能求出H-O键与H-Cl键的键能差.
解答:
解:设H-Cl键的键能为XkJ/mol,H-O键的键能为YkJ/mol,因反应热=反应物的总键能-生成物的总键能,所以
-
aakJ/mol=4XkJ/mol+bkJ/mol-2ckJ/mol-4YkJ/mol,所以Y-X=
,即断开1mol H-O键比断开1mol H-Cl 键所需能量高
kJ,
故选:B.
-
| a |
| 2 |
| a+2b-4c |
| 8 |
| a+2b-4c |
| 8 |
故选:B.
点评:本题主要考查了反应热与键能的关系,掌握反应热=反应物的总键能-生成物的总键能是解题的关键.

练习册系列答案
相关题目
常温下,下列溶液pH小于7的是( )
| A、CH3COONa |
| B、CuSO4 |
| C、NaOH |
| D、Na2CO3 |
氯气跟氢氧化钠溶液反应:Cl2+2NaOH→NaClO+NaCl+H2O,下列叙述中不正确的是( )
| A、氯气既是氧化剂,又是还原剂 |
| B、次氯酸钠是氧化产物,氯化钠是还原产物 |
| C、氢氧化钠既不是氧化剂,也不是还原剂 |
| D、电子的转移数是2,从氯气转移到氢氧化钠 |
主族元素X、Y、Z的离子的电子层结构相同,原子半径X>Z,离子半径Y>X,Y和Z能形成离子化合物,由此可判断三种元素的原子序数是( )
| A、X>Y>Z |
| B、Z>Y>X |
| C、Y>X>Z |
| D、X>Z>Y |
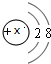 ,则该元素氧化物的化学式为
,则该元素氧化物的化学式为