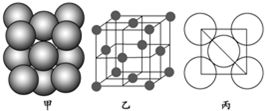
题目内容
7.下列有关平衡常数K的说法中正确的是( )| A. | 平衡常数与反应物或生成物的浓度变化无关,温度越高,平衡常数越大 | |
| B. | 25℃时,Mg(OH)2固体在同体积、同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者较小 | |
| C. | 25℃时NH4Cl溶液中的Kw大于100℃时NaCl溶液中的Kw | |
| D. | 2S℃时,H2SO3溶液的一级电离常数为Ka,则NaHSO3溶液的水解常数Kb=$\frac{Kw}{Ka}$ |
分析 A、平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
B、Ksp只与温度有关;
C、水的离子积常数随温度的升高而增大;
D、根据Ka=$\frac{[HS{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}S{O}_{3}]}$,Kb=$\frac{[{H}_{2}S{O}_{3}]•[{H}^{+}]}{[HS{{O}_{3}}^{-}]}$分析.
解答 解:A、.如果正反应是吸热反应,温度越高,平衡越向正反应方向移动,则K值越大,如果正反应是放热反应,温度越高,平衡越向逆反应方向移动,则K值越小,故A错误;
B、Ksp不随浓度变化,只与温度有关,所以Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,二者相同,故B错误;
C、温度越高水的离子积常数越大,故C错误;
D、Ka=$\frac{[HS{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}S{O}_{3}]}$,Kb=$\frac{[{H}_{2}S{O}_{3}]•[O{H}^{-}]}{[HS{{O}_{3}}^{-}]}$,所以Ka×Kb=KW,故D正确;
故选D.
点评 明确化学平衡K的含义是解本题关键,知道K值大小的影响因素,知道所有的平衡常数只与温度有关,与物质的浓度无关,化学平衡常数表达式中不含固体和纯液体,为易错点.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
20.当运动员肌肉挫伤时.队医随即对准运动员的受伤部位喷射药剂氯乙烷(化学式为C2H5Cl,沸点为12.3℃),进行局部冷冻麻醉处理.下列关于氯乙烷的说法错误的是( )
| A. | 氯乙烷是由碳、氢、氯三种元素组成的化合物 | |
| B. | 氯乙烷是由2个碳原子、5个氢原子和1个氯原子构成的 | |
| C. | 氯乙烷用于冷冻麻醉与其沸点较低,易挥发吸热有关 | |
| D. | 氯乙烷中碳、氢、氯三种元素的质量比为48:10:7l |
1.已知0.25molX气体的质量为8g,则X气体的摩尔质量是( )
| A. | 16g | B. | 32g | C. | 64g/mol | D. | 32g/mol |
2. 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
加热聚丙烯废塑料得到的产物如表:
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔.
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔
写出反应②、③的化学方程式②CaC2+2H2O→Ca(OH)2+C2H2↑,③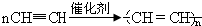 .
.
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质是甲苯(填名称),该物质与硝酸制取一种淡黄色晶体、烈性炸药的化学方程式为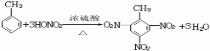 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.
(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔
写出反应②、③的化学方程式②CaC2+2H2O→Ca(OH)2+C2H2↑,③
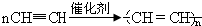 .
.(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质是甲苯(填名称),该物质与硝酸制取一种淡黄色晶体、烈性炸药的化学方程式为
 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
17. 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
(1)写出化合物Y所含的化学键名称离子键、共价键;
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)S2->Cl->Al3+;
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等.则原混合物中D单质的质量分数为30%;
(5)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH→CH3CH2ONa+H2↑.
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)S2->Cl->Al3+;
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等.则原混合物中D单质的质量分数为30%;
(5)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH→CH3CH2ONa+H2↑.
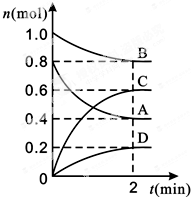 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题: