题目内容
17.已知Ksp(BaSO4)=1.1×10-10,若向50.00mL0.009mol•L-1Ba(NO3)2溶液中加入50.00mL 0.010mol•L-1稀硫酸,混合后溶液中c(Ba2+)=2.2×10-7 mol•L-1,pH=2.分析 根据向50.00mL0.009mol•L-1Ba(NO3)2溶液中加入50.00mL 0.010mol•L-1稀硫酸发生反应硫酸过量,生成硫酸钡沉淀,再由过量的硫酸根结合Ksp(BaSO4)=1.1×10-10,计算混合后溶液中c(Ba2+),由溶液中的氢离子浓度计算pH.
解答 解:向50.00mL0.009mol•L-1Ba(NO3)2溶液中加入50.00mL 0.010mol•L-1稀硫酸发生反应生成硫酸钡沉淀和硝酸,则过量的硫酸浓度为$\frac{0.01-0.009}{2}$=0.0005mol•L-1,又Ksp(BaSO4)=1.1×10-10,所以混合后溶液中c(Ba2+)=$\frac{1.1×10{\;}^{-10}}{0.0005}$=2.2×10-7mol•L-1,
因为反应前后没有消耗氢离子,所以混合后溶液中c(H+)=$\frac{0.010×2}{2}$mol/L=0.01mol/L,所以pH=2;
故答案为:2.2×10-7;2.
点评 本题考查难溶电解质的溶度积的计算以及pH值的计算,题目难度中等,注意溶液混合体积的变化.

练习册系列答案
相关题目
8.化工生产中常用FeS作为沉淀剂除去工业废水中的Pb2+,反应原理为FeS(s)+Pb2+(aq)?PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
| A. | 达到平衡时,c(Pb2+)=c(Fe2+) | |
| B. | Ksp(FeS)大于Ksp(PbS) | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(PbS)}$ | |
| D. | 溶液中加入少量Na2S固体后,c(Fe2+)减小 |
5.向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.
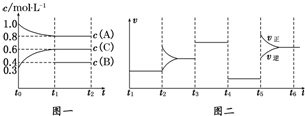
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=0.02 mol/(L•min).
(2)t4~t5阶段改变的条件为减小压强,B的起始物质的量为1.0 mol.各阶段平衡时对应的平衡常数如下表所示:
则K1=0.84(保留两位小数),K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5(用“>”、“<”或“=”连接).
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200a kJ/mol.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4,b+$\frac{1}{3}$c=1.2.

(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=0.02 mol/(L•min).
(2)t4~t5阶段改变的条件为减小压强,B的起始物质的量为1.0 mol.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g)△H=+200a kJ/mol.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4,b+$\frac{1}{3}$c=1.2.
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | ag C2H4和C3H6的混合物所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子数大于0.6NA |
9.下列说法正确的是( )
| A. | 溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 | |
| B. | 溶度积常数是不受任何条件影响的常数,简称溶度积 | |
| C. | 可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向 | |
| D. | 所有物质的溶度积都是随温度的升高而增大的 |
6.下列反应中,最终能生成+3价铁的化合物的是( )
①铁粉和稀盐酸②过量铁和稀硝酸③过量铁和FeCl3④氯水和FeCl2⑤FeO和稀硝酸⑥铁粉和足量稀硝酸 ⑦铁片投入CuSO4溶液⑧铁在Cl2中燃烧.
①铁粉和稀盐酸②过量铁和稀硝酸③过量铁和FeCl3④氯水和FeCl2⑤FeO和稀硝酸⑥铁粉和足量稀硝酸 ⑦铁片投入CuSO4溶液⑧铁在Cl2中燃烧.
| A. | ②③④⑥ | B. | ④⑤⑥⑧ | C. | ③④⑥⑧ | D. | ②③⑤⑥ |
7.下列过程中,涉及化学变化的是( )
| A. | 粗盐提纯 | B. | 蒸馏法将海水淡化为饮用水 | ||
| C. | 活性炭使红墨水褪色 | D. | 四氯化碳萃取碘水中的碘 |