题目内容
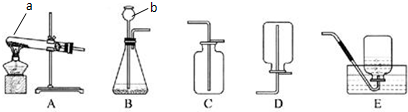
7.下列过程中,涉及化学变化的是( )| A. | 粗盐提纯 | B. | 蒸馏法将海水淡化为饮用水 | ||
| C. | 活性炭使红墨水褪色 | D. | 四氯化碳萃取碘水中的碘 |
分析 判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化,化学变化的特征是:在原子核不变的情况下,有新物质生成.判断物理变化和化学变化的依据是:是否有新物质生成.
解答 解:A.粗盐提纯过程中是通过沉淀离子过滤除去,过程中涉及化学变化,故A正确;
B.蒸馏法将海水淡化为饮用水是利用物质沸点不同,控制温度分离混合物,故B错误;
C.活性炭具有吸附作用,使红墨水褪色是吸附有色物质,属于物理变化,故C错误;
D.四氯化碳萃取碘水中的碘,是利用碘单质在四氯化碳和水中的溶解度不同,分离混合物,属于物理变化,故D错误;
故选A.
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决.题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
18.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2═HCN+NaNO2
NaCN+HF═HCN+NaF
NaNO2+HF═HNO2+NaF
由此可判断下列叙述不正确的是( )
NaCN+HF═HCN+NaF
NaNO2+HF═HNO2+NaF
由此可判断下列叙述不正确的是( )
| A. | K(HF)=7.2×10-4 | |
| B. | K(HNO2)=4.9×10-10 | |
| C. | 根据其中两个反应即可得出三种酸对应的电离常数 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
15.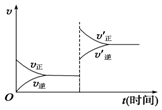 对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
 对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | Z、W中之一为气体,X、Y为非气体 | ||
| C. | X、Y、Z皆为气体,W为非气体 | D. | X、Y、Z、W皆为气体 |
2.下列电离方程式正确的是( )
| A. | AlCl3═Al3++Cl- | B. | Ca(OH)2═Ca2++(OH)2- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | Na2SO4═Na2++SO42- |
12.下列离子方程式书写正确的是( )
| A. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| B. | 氧化钠投入水中发生反应:O2-+H2O═2OH- | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| D. | 金属铁溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
19.下列说法正确的是( )
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C(碳)的燃烧热为110.5 kJ•mol-1 | |
| B. | 已知氢气燃烧热△H=-285.5 kJ•mol-1,则2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知中和热△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的稀溶液与1 mol NaOH固体混合,放出的热量小于57.3 kJ | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出热量28.7 kJ,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H>-57.4 kJ•mol-1 |