题目内容
将2.3g金属钠投入到足量水中,所得溶液的体积为100mL.计算:
(1)产生的气体的体积(在标准状况下);
(2)所得溶液溶质的物质的量浓度.
(1)产生的气体的体积(在标准状况下);
(2)所得溶液溶质的物质的量浓度.
考点:化学方程式的有关计算,物质的量浓度的相关计算
专题:计算题
分析:发生2Na+2H2O=2NaOH+H2↑,n(Na)=
=0.1mol,代入计算即可解答.
| 2.3g |
| 23g/mol |
解答:
解:(1)n(Na)=
=0.1mol,由2Na+2H2O=2NaOH+H2↑可知,生成气体为0.1mol×
=0.05mol,其标况下体积为0.05mol×22.4L/mol=1.12L,
答:产生的气体的体积为1.12L;
(2)n(NaOH)=n(Na)=0.1mol,则溶液溶质的物质的量浓度为
=1 mol?L-1,答:溶液溶质的物质的量浓度为1 mol?L-1.
| 2.3g |
| 23g/mol |
| 1 |
| 2 |
答:产生的气体的体积为1.12L;
(2)n(NaOH)=n(Na)=0.1mol,则溶液溶质的物质的量浓度为
| 0.1mol |
| 0.1L |
点评:本题考查化学方程式的有关计算,为高频考点,把握发生的反应是解答的关键,侧重分析能力及计算能力的考查,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
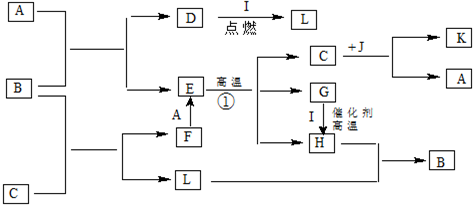
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:下列说法正确的是( )


| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、V=224 |
| C、样品中CuO的质量为2.0g |
| D、样品中Fe元素的质量为1.07g |
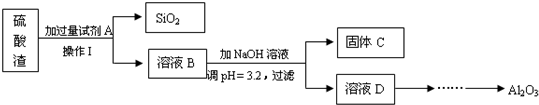
下列叙述中,不正确的是( )
| A、石英可用来制作工艺品 |
| B、硅单质可用来制造太阳能电池 |
| C、硅单质是制造玻璃的主要原料 |
| D、二氧化硅是制造光导纤维的材料 |
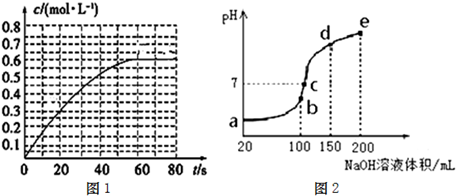
 某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.
某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.