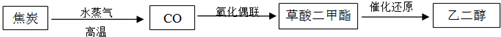题目内容
化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为 ;
已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1;
2CO(g)+2H2(g)?2C(s)+2H2O(g)的平衡常数为K2,则K2= .
(2)已知某温度下,反应2SO2+O2?2SO3的平衡常数K=19.在该温度下的体积固定的密闭容器中,SO2与O2的起始浓度为c0(SO2)=1mol?L-1,c0(O2)=1mol?L-1,当反应在该温度下SO2转化率为50%时,该反应 (填字母),请解释原因 .
A.向正方向移动 B.向逆方向移动 C.达到平衡 D.无法判断.
(1)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为
已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1;
2CO(g)+2H2(g)?2C(s)+2H2O(g)的平衡常数为K2,则K2=
(2)已知某温度下,反应2SO2+O2?2SO3的平衡常数K=19.在该温度下的体积固定的密闭容器中,SO2与O2的起始浓度为c0(SO2)=1mol?L-1,c0(O2)=1mol?L-1,当反应在该温度下SO2转化率为50%时,该反应
A.向正方向移动 B.向逆方向移动 C.达到平衡 D.无法判断.
考点:化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据化学方程式和平衡常数概念书写表达式;结合反应的平衡常数表达式分析计算,注意固体不写入表达式;
(2)依据化学平衡三段式列式计算SO2转化率为50%时各物质的浓度,计算浓度商,结合平衡常数比较分析判断 反应进行的方向;
(2)依据化学平衡三段式列式计算SO2转化率为50%时各物质的浓度,计算浓度商,结合平衡常数比较分析判断 反应进行的方向;
解答:
解:(1)反应C(s)+CO2(g)?2CO(g),平衡常数的表达式K=
;
已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1=
2CO(g)+2H2(g)?2C(s)+2H2O(g)的平衡常数为K2 =
,则K2=
;
故答案为:
,
;
(2)已知某温度下,反应2SO2+O2?2SO3的平衡常数K=19.在该温度下的体积固定的密闭容器中,SO2与O2的起始浓度为c0(SO2)=1mol?L-1,c0(O2)=1mol?L-1,当反应在该温度下SO2转化率为50%时,依据化学平衡三段式列式;
2SO2+O2?2SO3
起始量(mol/L) 1 1 0
变化量(mol/L)0.5 0.25 0.5
某时刻(molL)0.5 0.75 0.5
Qc=
=1.3<K=16
说明反应正反应方向进行;
故答案为:A,Qc<K;
| c2(CO) |
| c(CO2) |
已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1=
| c(CO)c(H2) |
| c(H2O) |
2CO(g)+2H2(g)?2C(s)+2H2O(g)的平衡常数为K2 =
| c2(H2O) |
| c2(CO)c2(H2) |
| 1 |
| K12 |
故答案为:
| c2(CO) |
| c(CO2) |
| 1 |
| K12 |
(2)已知某温度下,反应2SO2+O2?2SO3的平衡常数K=19.在该温度下的体积固定的密闭容器中,SO2与O2的起始浓度为c0(SO2)=1mol?L-1,c0(O2)=1mol?L-1,当反应在该温度下SO2转化率为50%时,依据化学平衡三段式列式;
2SO2+O2?2SO3
起始量(mol/L) 1 1 0
变化量(mol/L)0.5 0.25 0.5
某时刻(molL)0.5 0.75 0.5
Qc=
| 0.52 |
| 0.52×0.75 |
说明反应正反应方向进行;
故答案为:A,Qc<K;
点评:本题考查了化学平衡影响因素,平衡常数概念分析计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
关于下列各装置图的叙述中,不正确的是( )
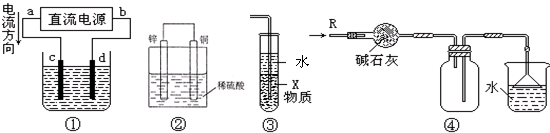

| A、若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| B、装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应 |
| C、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
工业上利用硅的氧化物制取硅单质,主要反应为:SiO2+2C
Si+2CO↑.该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了1mol C,则生成 mol Si.
| ||
银锌电池广泛用作各种电子仪器的电源,它的电池反应是Zn+Ag2OH2O=2Ag+Zn(OH)2则负极上发生反应的物质是( )
| A、Ag |
| B、Zn(OH)2 |
| C、Ag2O |
| D、Zn |
 某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.
某离子反应中涉及N2、H2O、ClO-、H+、NH4+、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图.