题目内容
8.向200mL 2mol•L-1 HNO3溶液中逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)的变化如图所示.下列有关说法正确的是( )
| A. | 该过程中产生标准状况下4.48L H2 | |
| B. | 向c点处的反应液中加入稀盐酸后无明显现象 | |
| C. | 图中a=1.5 | |
| D. | 当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol |
分析 A、产生的气体是一氧化氮;
B、加入稀盐酸,氢离子、硝酸根离子和亚铁离子发生氧化还原反应;
C、成的气体只有一种,生成HNO3的还原产生是一氧化氮,氧化性硝酸占整个硝酸的$\frac{1}{4}$;
D、硝酸与铁反应生成铁离子时最大量消耗铁的物质的量为:0.2L×2mol•L-1=0.4mol,所以氧化的硝酸的物质的量为:0.4mol×$\frac{1}{4}$=0.1mol,所以转移电子的物质的量为0.3mol,所以参加反应铁的最大量为:0.1mol.
解答 解:A、产生的气体是一氧化氮,而不是氢气,故A错误;
B、加入稀盐酸,氢离子、硝酸根离子和亚铁离子发生氧化还原反应,所以现象是有气泡产生,气体遇空气变红棕色,故B错误;
C、成的气体只有一种,生成HNO3的还原产生是一氧化氮,氧化性硝酸占整个硝酸的$\frac{1}{4}$,所以氧化的硝酸的物质的量为:0.4mol×$\frac{1}{4}$=0.1mol,根据转移电子的物质的量相等,所以亚铁离子的物质的量为:$\frac{0.1×3}{2}$=0.15mol,所以a=0.15,故C错误;
D、硝酸与铁反应生成铁离子时最大量消耗铁的物质的量为:0.2L×2mol•L-1=0.4mol,所以氧化的硝酸的物质的量为:0.4mol×$\frac{1}{4}$=0.1mol,所以转移电子的物质的量为0.3mol,所以参加反应铁的最大量为:0.1mol,所以b=0.1mol,则根据电子转移相等,3n(Fe3+)+2n(Fe2+)=0.1×3,所以n(Fe3+)=(0.3-2n)mol,故D正确;
故选D.
点评 本题考查学生金属铁所发生的氧化还原反应知识,注意平时知识的积累是解题的关键,综合性较强,结合图象考查增加了难度.

①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②氧化物不是酸性氧化物就是碱性氧化物
③根据是否含有氧原子,酸可分为含氧酸和无氧酸.
| A. | 仅①③ | B. | 仅②③ | C. | 仅①② | D. | 仅③ |
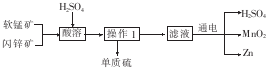
操作1过程中必须使用的仪器是( )
| A. | 蒸发皿 | B. | 漏斗 | C. | 蒸馏烧瓶 | D. | 容量瓶 |
| A. | 钙、铁、锌、硒都是人体必需的微量元素 | |
| B. | 发现煤气泄漏应立即关闭阀门,开窗通风 | |
| C. | 用肥皂水可鉴别硬水和软水 | |
| D. | 氢能源的大量应用需解决制取成本高、贮存困难等问题 |
| A. | 硫酸 | B. | 二氧化碳 | C. | 硝酸锌 | D. | 氯化铜 |
 )中所含有的共价键数目为( )
)中所含有的共价键数目为( )| A. | NA | B. | 0.7NA | C. | 1.9NA | D. | 7NA |
| A. | 升高温度,AgCl的溶解度减小 | |
| B. | 在任何含AgCl固体的水溶液中,c(Ag+)=c(Cl-)且二者乘积是一个常数 | |
| C. | AgCl沉淀生成和溶解不断进行,但速率相等 | |
| D. | 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解的质量不变 |
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体.反应化学方程式可表示为:2xCO+2NOx $\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质.某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程.
提供的装置:

①所提供的装置中能快速、简便制取NH3的装置是:H(填仪器序号).
| 试剂组合序号 | 固体试剂(g) | NH3体积(mL) | |
| a | 12.0g Ca(OH)2 (过量) | 10.8g NH4Cl | 2688 |
| b | 10.8g (NH4)2SO4 | 2728 | |
| c | 12.0g NaOH (过量) | 10.8g NH4Cl | 3136 |
| d | 10.8g (NH4)2SO4 | 3118 | |
| e | 12.0g CaO (过量) | 10.8g NH4Cl | 3506 |
| f | 10.8g (NH4)2SO4 | 3584 | |
分析表中数据,实验室制NH3产率最高的是:f(填序号),其它组合NH3产率不高的原因是:因为用NH4Cl和NaOH或Ca(OH)2作反应物生成氨气的同时产生的水较多,则吸收溶解的NH3较多.
模拟尾气的处理
(3)选用上述部分装置,按下列顺序连接成模拟尾气处理装置:

①A中反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是:防止氨气溶解(或防止倒吸).
③D装置中的液体可换成c(填序号).
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是:未反应的NO无法处理,会污染环境.
 实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果.根据要求回答下列问题:
实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果.根据要求回答下列问题: