题目内容
3.将铁屑溶于过量盐酸后,再加入或通入下列物质,会有Fe3+生成的是( )| A. | 硫酸 | B. | 二氧化碳 | C. | 硝酸锌 | D. | 氯化铜 |
分析 铁屑溶于盐酸后,溶液中主要是H+、Cl-、Fe2+,若要将Fe2+变为Fe3+,需要强氧化性物质.
解答 解:二价铁离子变为三价铁离子发生了氧化反应,应加入氧化性的物质,在H+存在的情况下,NO3-表现强氧化性,发生反应:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;硫酸必须是浓硫酸才有强氧化性,稀硫酸没有氧化性;二氧化碳不具有氧化性;Cu2+氧化性很弱,不能氧化二价铁离子,
故选:C.
点评 本题考查了铁及其化合物的性质,熟悉氧化还原反应的规律是解题关键,需要注意的是在H+存在的情况下,NO3-表现强氧化性.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
13.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 L l mol•L-1 Na2CO3溶液中,阴离子总数大于0.1NA | |
| B. | 标准状况下,22.4 L氦气中含有的原子数为2NA | |
| C. | 100 g 98%的浓硫酸中,氧原子总数为4NA | |
| D. | 4.6 g组成为C2H6O的有机物,C-H键数目不一定为0.5NA |
14.有关如图所示的两套电化学装置的说法正确的是( )
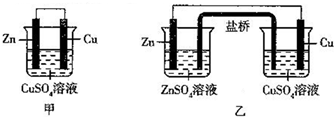

| A. | 甲是原电池、乙是电解池 | |
| B. | 铜电极上的电极反应式均为Cu2++2e-=Cu | |
| C. | 甲装置放电效率高于乙装置 | |
| D. | 当有6.5 g Zn溶解时,乙装置中会有0.2 mol电子通过盐桥 |
11.【探究一:该白色固体的成分】
“滴水生火”魔术是用胶头滴管将水滴到包裹淡黄色固体过氧化钠的棉花上,棉花燃烧起来,淡黄色固体完全变为白色固体.滴水时发生反应:2Na2O2+2H2O﹦4NaOH+O2↑
某兴趣小组对该白色固体的成分及含量进行探究.
探究一:该白色固体的成分
猜想Ⅰ:该白色固体为氢氧化钠
猜想Ⅱ:该白色固体为碳酸钠
猜想Ⅲ:该白色固体为氢氧化钠与碳酸钠的混合物
(1)经分析,上述猜测Ⅰ不合理.
(2)为确定该白色固体的成分,小明同学设计了如下实验方案,请你一起完成下列实验报告:(实验室可供选择的试剂有:氯化钡溶液、酚酞、澄清石灰水、稀盐酸)
“滴水生火”魔术是用胶头滴管将水滴到包裹淡黄色固体过氧化钠的棉花上,棉花燃烧起来,淡黄色固体完全变为白色固体.滴水时发生反应:2Na2O2+2H2O﹦4NaOH+O2↑
某兴趣小组对该白色固体的成分及含量进行探究.
探究一:该白色固体的成分
猜想Ⅰ:该白色固体为氢氧化钠
猜想Ⅱ:该白色固体为碳酸钠
猜想Ⅲ:该白色固体为氢氧化钠与碳酸钠的混合物
(1)经分析,上述猜测Ⅰ不合理.
(2)为确定该白色固体的成分,小明同学设计了如下实验方案,请你一起完成下列实验报告:(实验室可供选择的试剂有:氯化钡溶液、酚酞、澄清石灰水、稀盐酸)
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品溶于水,加入过量的氯化钡溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅲ成立 |
18.如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )


| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等 | |
| C. | 若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲 | |
| D. | 若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法 |
8.向200mL 2mol•L-1 HNO3溶液中逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)的变化如图所示.下列有关说法正确的是( )

| A. | 该过程中产生标准状况下4.48L H2 | |
| B. | 向c点处的反应液中加入稀盐酸后无明显现象 | |
| C. | 图中a=1.5 | |
| D. | 当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol |
1.在100mL 0.01mol/L KCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10)( )
| A. | 有AgCl沉淀析出 | B. | 无AgCl沉淀 | ||
| C. | 无法确定 | D. | 有沉淀但不是AgCl |
18.将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量不变的是( )
| A. | H2SO4 | B. | C2H5OH | C. | Ca(OH)2 | D. | HNO3 |