题目内容
19.工业上用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn的工艺流程如下: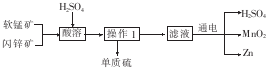
操作1过程中必须使用的仪器是( )
| A. | 蒸发皿 | B. | 漏斗 | C. | 蒸馏烧瓶 | D. | 容量瓶 |
分析 软锰矿和闪锌矿加入硫酸,发生氧化还原反应可生成硫、硫酸锌和硫酸锰,过滤得到硫,滤液中含有硫酸锰、硫酸锌和硫酸,电解,得到锌、二氧化锰和硫酸,以此确定实验用到的仪器.
解答 解:软锰矿和闪锌矿加入硫酸,发生氧化还原反应可生成硫、硫酸锌和硫酸锰,过滤得到硫,滤液中含有硫酸锰、硫酸锌和硫酸,电解,得到锌、二氧化锰和硫酸,实验需要过滤操作,使用的仪器是:漏斗、玻璃棒、烧杯、滤纸等.
故选B.
点评 本题以实验流程题目考查学生化学实验基本操作知识,属于基本知识的考查,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列说法中正确的是(NA为阿伏加德罗常数的值)( )
| A. | 1mol苯分子中所含的C=C键数为3NA | |
| B. | 60gSiO2中含有Si-O键的个数为2NA | |
| C. | 0.1molCnH2n+2中含有的碳碳单键数为0.1nNA | |
| D. | 18 g冰中含氢键的个数为2NA |
10.关于苯,下列说法正确的是( )
| A. | 苯不溶于水,密度比水大 | |
| B. | 苯不能发生氧化反应 | |
| C. | 除去苯中混有的少量甲苯,可以用酸性高锰酸钾溶液 | |
| D. | 苯可以跟溴水反应制取溴苯 |
7.自来水处理剂经历三代变化,第一代氯气,第二代二氧化氯,第三代高铁酸钾(K2FeO4).高铁酸钾是一种新型、高效、多功能绿色水处理剂,无二次水体污染.工业制备高铁酸钠的方法之一为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2,下列说法正确的是( )
| A. | 该反应的还原剂只有FeSO4 | |
| B. | 每生成1mol Na2FeO4只转移5mol的电子 | |
| C. | K2FeO4作为水处理剂时仅起杀菌消毒的作用 | |
| D. | 该反应在水溶液中进行并不影响高铁酸钾的生产 |
14.有关如图所示的两套电化学装置的说法正确的是( )
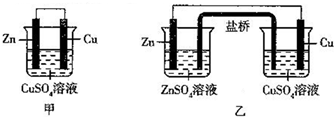

| A. | 甲是原电池、乙是电解池 | |
| B. | 铜电极上的电极反应式均为Cu2++2e-=Cu | |
| C. | 甲装置放电效率高于乙装置 | |
| D. | 当有6.5 g Zn溶解时,乙装置中会有0.2 mol电子通过盐桥 |
4.建立宏观和微观之间的联系是化学学科特有的思维方式.下列对宏观事实的微观解释错误的是( )
| A. | 水的三态变化--分子的间隔和排列方式发生了改变 | |
| B. | 闻到远处饭菜的香味--分子在不断的运动 | |
| C. | 水通电分解--分子在化学变化中可以再分 | |
| D. | 夏天钢轨之间的缝隙变小--原子受热时体积变大 |
11.【探究一:该白色固体的成分】
“滴水生火”魔术是用胶头滴管将水滴到包裹淡黄色固体过氧化钠的棉花上,棉花燃烧起来,淡黄色固体完全变为白色固体.滴水时发生反应:2Na2O2+2H2O﹦4NaOH+O2↑
某兴趣小组对该白色固体的成分及含量进行探究.
探究一:该白色固体的成分
猜想Ⅰ:该白色固体为氢氧化钠
猜想Ⅱ:该白色固体为碳酸钠
猜想Ⅲ:该白色固体为氢氧化钠与碳酸钠的混合物
(1)经分析,上述猜测Ⅰ不合理.
(2)为确定该白色固体的成分,小明同学设计了如下实验方案,请你一起完成下列实验报告:(实验室可供选择的试剂有:氯化钡溶液、酚酞、澄清石灰水、稀盐酸)
“滴水生火”魔术是用胶头滴管将水滴到包裹淡黄色固体过氧化钠的棉花上,棉花燃烧起来,淡黄色固体完全变为白色固体.滴水时发生反应:2Na2O2+2H2O﹦4NaOH+O2↑
某兴趣小组对该白色固体的成分及含量进行探究.
探究一:该白色固体的成分
猜想Ⅰ:该白色固体为氢氧化钠
猜想Ⅱ:该白色固体为碳酸钠
猜想Ⅲ:该白色固体为氢氧化钠与碳酸钠的混合物
(1)经分析,上述猜测Ⅰ不合理.
(2)为确定该白色固体的成分,小明同学设计了如下实验方案,请你一起完成下列实验报告:(实验室可供选择的试剂有:氯化钡溶液、酚酞、澄清石灰水、稀盐酸)
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品溶于水,加入过量的氯化钡溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅲ成立 |
8.向200mL 2mol•L-1 HNO3溶液中逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)的变化如图所示.下列有关说法正确的是( )

| A. | 该过程中产生标准状况下4.48L H2 | |
| B. | 向c点处的反应液中加入稀盐酸后无明显现象 | |
| C. | 图中a=1.5 | |
| D. | 当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol |
15.下列物质中既含有离子键又含有共价键的是( )
| A. | H2O | B. | CH3CH2OH | C. | Na2O | D. | NaOH |