题目内容
4.氮的氧化物(用NOx表示)是大气污染物,必须加以处理.(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体.反应化学方程式可表示为:2xCO+2NOx $\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质.某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程.
提供的装置:

①所提供的装置中能快速、简便制取NH3的装置是:H(填仪器序号).
| 试剂组合序号 | 固体试剂(g) | NH3体积(mL) | |
| a | 12.0g Ca(OH)2 (过量) | 10.8g NH4Cl | 2688 |
| b | 10.8g (NH4)2SO4 | 2728 | |
| c | 12.0g NaOH (过量) | 10.8g NH4Cl | 3136 |
| d | 10.8g (NH4)2SO4 | 3118 | |
| e | 12.0g CaO (过量) | 10.8g NH4Cl | 3506 |
| f | 10.8g (NH4)2SO4 | 3584 | |
分析表中数据,实验室制NH3产率最高的是:f(填序号),其它组合NH3产率不高的原因是:因为用NH4Cl和NaOH或Ca(OH)2作反应物生成氨气的同时产生的水较多,则吸收溶解的NH3较多.
模拟尾气的处理
(3)选用上述部分装置,按下列顺序连接成模拟尾气处理装置:

①A中反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是:防止氨气溶解(或防止倒吸).
③D装置中的液体可换成c(填序号).
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是:未反应的NO无法处理,会污染环境.
分析 (1)CO和NOx在催化剂的条件下反应生成参与大气循环的无毒气体应为CO2和N2;
(2)①制备氨气可采用加热NH4Cl和Ca(OH)2或浓氨水加热的方法或者浓氨水滴加到生石灰中制备;
②根据NaOH或Ca(OH)2作反应物产生的水较多易溶解生成的氨气来分析;
(3)①稀硝酸具有强氧化性,与铜发生氧化还原反应生成硝酸铜和NO等;
②氨气难溶于饱和氨水,可防止倒吸;
③氨气为极性分子,不溶于非极性溶剂;
④缺少尾气处理装置,过量的NO会污染空气.
解答 解:(1)CO和NOx在催化剂的条件下反应生成参与大气循环的无毒气体应为CO2和N2,反应的化学方程式为2xCO+2NOx $\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2,
故答案为:2xCO+2NOx $\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2;
(2)①制备氨气可采用加热NH4Cl和Ca(OH)2或浓氨水加热的方法或者浓氨水滴加到生石灰中制备,其中能快速、简便制取NH3的装置可用浓氨水滴加到生石灰中制备,用H装置,故答案为:H;
②因为用NH4Cl和NaOH或Ca(OH)2作反应物生成氨气的同时产生的水较多,则吸收溶解的NH3较多,所以由表中数据可以看出,f制NH3产率最高,
故答案为:f;因为用NH4Cl和NaOH或Ca(OH)2作反应物生成氨气的同时产生的水较多,则吸收溶解的NH3较多;
(3)①稀硝酸具有强氧化性,与铜发生氧化还原反应生成硝酸铜和NO等,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
②D装置使气体混合均匀、调节气流速度,另外,氨气难溶于饱和氨水,可防止倒吸,
故答案为:防止氨气溶解(或防止倒吸);
③氨气可溶于硫酸铜溶液、水以及硫酸中,可产生倒吸,氨气为极性分子,不溶于非极性溶剂,可用CCl4代替饱和氨水,
故答案为:c;
④缺少尾气处理装置,过量的NO会污染空气,故答案为:未反应的NO无法处理,会污染环境.
点评 本题考查氮的氧化物的性质以及对环境的影响,题目难度中等,做题时注意实验的原理和目的,牢固掌握实验方法和实验基本操作为解答该类题目的前提.

 阅读快车系列答案
阅读快车系列答案
| A. | 该过程中产生标准状况下4.48L H2 | |
| B. | 向c点处的反应液中加入稀盐酸后无明显现象 | |
| C. | 图中a=1.5 | |
| D. | 当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol |
| A. | H2O | B. | CH3CH2OH | C. | Na2O | D. | NaOH |
| A. | CaH2 | B. | H2O2 | C. | Na2O2 | D. | KOH |

| A. | 2-甲基-3-丁炔 | B. | 2-甲基-1-丙醇 | C. | 2-甲基丁烷 | D. | 二氯丙烷 |
| A. | CuO→Cu(OH)2 | B. | Cu→CuSO4 | C. | MgSO4→MgCl2 | D. | NaCl→NaOH |
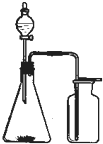 ①浓氨水和固体NaOH制NH3
①浓氨水和固体NaOH制NH3