题目内容
11.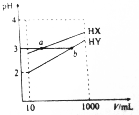 常温下,10mL浓度均为0.1mol/L的HX和HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.则下列说法正确的是( )
常温下,10mL浓度均为0.1mol/L的HX和HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.则下列说法正确的是( )| A. | HX的电离常数K(HX)大于HY的电离常数K(HY) | |
| B. | a点水的电离程度大于b点水的电离程度 | |
| C. | a、b两点对应的两种酸等体积混合后溶液的pH大于混合前溶液的pH | |
| D. | 浓度均为0.1mol/L的NaX和NaY组成的混合溶液中c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+) |
分析 浓度均为0.1mol/L的HX和HY两种一元酸,HY溶液的pH=2,HX的pH=3,说明HY溶液中氢离子浓度大于HX,则HY的酸性比HX强,酸性越强,对应盐是水解程度越大,结合酸对水的电离影响分析.
解答 解:A.浓度均为0.1mol/L的HX和HY两种一元酸,HY溶液的pH=2,HX的pH=3,说明HY溶液中氢离子浓度大于HX,则HY的酸性比HX强,所以HX的电离常数K(HX)小于HY的电离常数K(HY),故A错误;
B.ab两点溶液中氢离子浓度相同,对水的电离的抑制程度相同,所以a点水的电离程度等于b点水的电离程度,故B错误;
C.ab两点溶液中氢离子浓度相同,a、b两点对应的两种酸等体积混合后溶液的pH等于混合前溶液的pH,故C错误;
D.HY的酸性比HX强,则NaX的水解程度大,所以溶液中c(Y-)>c(X-),则溶液中离子浓度大小关系:c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+),故D正确.
故选D.
点评 本题考查强弱电解质溶液稀释时的pH、浓度变化、盐的水解,侧重于学生的分析能力的考查,注意加水促进弱电解质电离的特点,难度不大.

练习册系列答案
相关题目
6.试管内壁附着的以下物质用KOH溶液(必要时可加热)难以洗去的是( )
| A. | 硫 | B. | 油渍 | C. | 石炭酸 | D. | 酚醛树脂 |
16.苹果酸的结构简式如图所示,下列说法正确的是( )


| A. | 苹果酸的分子式为C4H8O5 | |
| B. | 苹果酸能与Na、NaOH反应,但不能与NaHCO3反应 | |
| C. | 苹果酸既能发生酯化反应,又能缩聚成高分子化合物 | |
| D. | 2分子苹果酸相互反应可形成两种环状的酯类物质 |
6.已知:C(s)+O2(g)=CO2(g)△H1
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H4
下列关于上述反应焓变的判断正确的是( )
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H4
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0 | B. | △H2<0 | C. | △H3<0 | D. | △H4<0 |
3.根据碘与氢气反应的热化学方程式(碘为气态或固态),下列判断正确的是( )
(ⅰ) I2(?)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ) I2(?)+H2(g)?2HI(g)△H=26.48kJ/mol.
(ⅰ) I2(?)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ) I2(?)+H2(g)?2HI(g)△H=26.48kJ/mol.
| A. | ⅰ中碘为气态,ⅱ中碘为固态 | |
| B. | 反应(ⅰ)的产物比反应(ⅱ)的产物稳定 | |
| C. | 1 mol I2(g)中通入1 mol H2(g),反应放热9.48 kJ | |
| D. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
4.下列各组物质中,化学键类型完全相同的是( )
| A. | SiO2和H2O | B. | SO2和Na2O2 | C. | NaCl和HCl | D. | AlCl3和KCl |
 实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量SO2.有人设计下列实验以确认上述混合气体中有乙烯和SO2.
实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量SO2.有人设计下列实验以确认上述混合气体中有乙烯和SO2.