题目内容
下列说法正确的是( )
| A、已知氢元素有1H、2H、3H三种同位素,氧元素有16O、18O两种同位素,则它们之间形成的化合物有30种 | ||||||||
| B、能够使pH试纸显红色的溶液pH一定大于7 | ||||||||
| C、已知反应:2(CaO?MgO)(s)+Si(s)?CaSiO4(l)+2Mg(g),在密闭的还原炉内达到平衡后,若其他条件均不改变,将还原炉体积缩小一半,则达到新平衡是Mg(g)的浓度将升高 | ||||||||
D、
|
考点:有关反应热的计算,同位素及其应用,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:A.氢元素与氧元素能形成两种化合物,先按化合物的类型分类,再按氢元素与氧元素同位素相同与不同情况分类,同时注意两种化合物分子结构的对称性;
B.酸性溶液能使pH试纸变红色;
C.从平衡常数的角度分析;
D.依据反应焓变△H=反应物键能总和-生成物键能总和来分析计算;
B.酸性溶液能使pH试纸变红色;
C.从平衡常数的角度分析;
D.依据反应焓变△H=反应物键能总和-生成物键能总和来分析计算;
解答:
解:A.解:由H、O两种元素组成的化合物有两种H2O、H2O2.
对于H2O:
H的取法有C(23)+3×(2-1)=6
而O的取法有C(12)+2×(1-1)=2
故共有6×2=12种
同理,对于H2O2:
相同的氢同位素与相同的氧同位素形成H2O2的种数C13C12=6
相同的氢同位素与不同的氧同位素形成H2O2的种数
=3
不同的氢同位素与相同的氧同位素形成H2O2的种数C13C12=6
不同的氢同位素与不同的氧同位素形成H2O2的种数
=6
综上所述,一共有33种,故A错误;
B.酸性溶液能使pH试纸变红色,则能够使pH试纸显红色的溶液pH一定小于7,故B错误;
C.已知反应:2(CaO?MgO)(s)+Si(s)?CaSiO4(l)+2Mg(g),在密闭的还原炉内达到平衡后,若其他条件均不改变,将还原炉体积缩小一半,因温度不变,平衡常数不变,且只有为气体Mg(g),K=c2(Mg),则Mg(g)的浓度不变,故C错误;
D.已知晶体硅的燃烧热为989.2kJ?mol-1,则Si(s)+O2(g)=SiO2(s)△H=-989.2kJ?mol-1;1mol晶体硅中含有2molSi-Si,1molSiO2中含有4molSi-O,1molO2中含有1molO=O;则2×176+498.8-4X=-989.2,解得X=460,故D正确;
故选D.
对于H2O:
H的取法有C(23)+3×(2-1)=6
而O的取法有C(12)+2×(1-1)=2
故共有6×2=12种
同理,对于H2O2:
相同的氢同位素与相同的氧同位素形成H2O2的种数C13C12=6
相同的氢同位素与不同的氧同位素形成H2O2的种数
| C13C12 |
| 2 |
不同的氢同位素与相同的氧同位素形成H2O2的种数C13C12=6
不同的氢同位素与不同的氧同位素形成H2O2的种数
| P23P22 |
| 2 |
综上所述,一共有33种,故A错误;
B.酸性溶液能使pH试纸变红色,则能够使pH试纸显红色的溶液pH一定小于7,故B错误;
C.已知反应:2(CaO?MgO)(s)+Si(s)?CaSiO4(l)+2Mg(g),在密闭的还原炉内达到平衡后,若其他条件均不改变,将还原炉体积缩小一半,因温度不变,平衡常数不变,且只有为气体Mg(g),K=c2(Mg),则Mg(g)的浓度不变,故C错误;
D.已知晶体硅的燃烧热为989.2kJ?mol-1,则Si(s)+O2(g)=SiO2(s)△H=-989.2kJ?mol-1;1mol晶体硅中含有2molSi-Si,1molSiO2中含有4molSi-O,1molO2中含有1molO=O;则2×176+498.8-4X=-989.2,解得X=460,故D正确;
故选D.
点评:本题考查了化合物的构成、pH试纸的使用、化学平衡移动、键能与反应热的关系等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

练习册系列答案
相关题目
实验室中需要配制2mol?L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A、950 mL,111.2 g |
| B、500 mL,117 g |
| C、1 000 mL,117 g |
| D、1 000 mL,111.2 g |
下列与生活相关的叙述错误的是( )
| A、酸性臭氧水(AOW)可用于消灭HlNl病毒,因为臭氧具有强氧化性 |
| B、水的处理常用到漂白粉和明矾,二者的作用原理相同 |
| C、二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成 |
| D、地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |
在合成氨工业中,为增加氨气的日产量,在过程中与平衡移动无关的是( )
| A、不断分离出液氨 |
| B、使用催化剂 |
| C、采用500℃的高温 |
| D、采用20-50Mp的压强 |
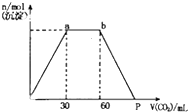 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
| A、9.5 | B、10.5 |
| C、11.5 | D、12.5 |
已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2 下列关于该反应的叙述不正确的是( )
| A、该反应中,氧化剂与还原剂物质的量之比为9:5 | ||
B、当反应中有1mol电子转移时,被还原氯气物质的量为
| ||
| C、每产生1mol O2时,被氧元素还原的氯气物质的量为2mol | ||
D、参加反应的水有
|

