题目内容
15.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | ①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液,若3种溶液pH均为9,则它们物质的量浓度大小顺序是①>②>③ |
分析 A.某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,该溶液可能为酸性或碱性;
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度也可能是c(Na+)>c(OH-)>c(S2-)>c(HS-)>c(H+)或c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+);
C.反应后溶液为NaA与HA等物质的量混合.反应后溶液pH大于7,说明NaA的水解作用大于HA的电离作用,结合电荷守恒、物料守恒判断;
D.Na2CO3溶液、CH3COONa溶液都是强碱弱酸盐,水解使溶液显碱性,而NaOH是强碱,完全电离,若3种溶液pH均为9,结合盐的水解原理分析.
解答 解:A.某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7时,则该溶液的pH可能为(14-a),也可能是a,故A错误;
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度可能是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),也可能是c(Na+)>c(OH-)>c(S2-)>c(HS-)>c(H+)或c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+),故B错误;
C.将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合发生反应:HA+NaOH=NaA+H2O,反应后溶液为NaA与HA等物质的量混合.反应后溶液pH大于7,说明NaA的水解作用大于HA的电离作用,根据电荷守恒可得c(Na+)+c(H+)=c(A-)+c(OH-),根据物料守恒可得:c(A-)+c(HA)=2c(Na+),将第一个式子扩大2倍加上第二个式子,整理可得2c(OH-)=2c(H+)+c(HA)-c(A-),故C正确;
D.Na2CO3溶液、CH3COONa溶液都是强碱弱酸盐,水解使溶液显碱性,当物质的浓度相等时,酸越弱,盐水解程度就越大,盐溶液的碱性就越强,而NaOH是强碱,完全电离,若3种溶液pH均为9,则它们物质的量浓度大小顺序是②>①>③,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

| A. | 在25℃、1.01×105Pa的条件下,2.24 L H2中含有的分子数小于0.1NA | |
| B. | 1 L 1 mol•L-1的CaCl2溶液中含Cl-的数目为NA | |
| C. | 在标准状况下,22.4 L H2O的质量约为18 g | |
| D. | 22 g CO2与标准状况下11.2 L H2O含有相同的分子数 |
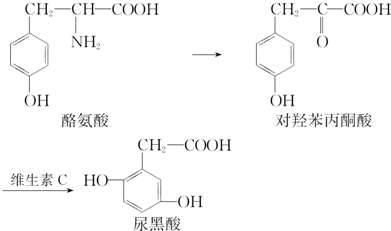
| A. | 酪氨酸既能与盐酸反应又能与NaOH溶液反应 | |
| B. | 对羟苯丙酮酸分子中有2种含氧官能团 | |
| C. | 1 mol尿黑酸最多可与含1 mol NaOH的溶液反应 | |
| D. | 可用溴水鉴别对羟苯丙酮酸与尿黑酸 |
| A. | 将15.6 g Na2O2和5.4 g Al同时放入一定量的水中可以产生标况下气体6.72 L | |
| B. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该气体能使品红溶液褪色,则该溶液可能既含有SO32-又含有CO32- | |
| C. | 大多数碳的化合物都是共价化合物,其原因是碳元素有三种同位素 | |
| D. | 石油分馏可获得乙烯、丙烯和丁二烯 |
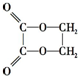 )时最合理的合成路线需经下列反应:
)时最合理的合成路线需经下列反应:①取代反应
②加成反应
③氧化反应
④还原反应
⑤消去反应
⑥酯化反应
下列有关合成乙二酸乙二酯的过程中反应类型的顺序正确的是( )
| A. | ①②③⑤⑥ | B. | ⑤②①③⑥ | C. | ⑥③①②⑤ | D. | ①②⑤③⑥ |
 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,E是重要的建筑材料,F可用于清除铁锈.它们之间的转化关系如图所示(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).回答下列问题:
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,E是重要的建筑材料,F可用于清除铁锈.它们之间的转化关系如图所示(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).回答下列问题: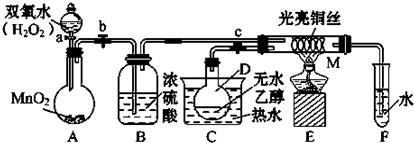
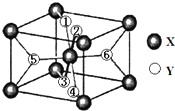 在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.