题目内容
4.下列说法正确的是( )| A. | 将15.6 g Na2O2和5.4 g Al同时放入一定量的水中可以产生标况下气体6.72 L | |
| B. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该气体能使品红溶液褪色,则该溶液可能既含有SO32-又含有CO32- | |
| C. | 大多数碳的化合物都是共价化合物,其原因是碳元素有三种同位素 | |
| D. | 石油分馏可获得乙烯、丙烯和丁二烯 |
分析 A.15.6gNa2O2的物质的量为:$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物质的量为:$\frac{5.4g}{27g/mol}$=0.2mol,2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,说明气体可能为CO2、SO2,该气体能使品红溶液褪色证明一定含SO2;
C.碳原子最外层有四个电子得到和失去电子能力相近,主要形成的化合物为共价化合物;
D.石油是由多种烷烃和环烷烃组成的混合物.
解答 解:A.15.6gNa2O2的物质的量为:$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物质的量为:$\frac{5.4g}{27g/mol}$=0.2mol,
2Na2O2+2H2O═4NaOH+O2↑
0.2mol 0.4mol 2.24L
2Al+2H2O+2NaOH═2NaAlO2+3H2↑
0.2mol 0.2mol 0.2mol 6.72L
反应中得到气体的总体积为:2.24L+6.72L=8.96L,故A错误;
B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,说明气体可能为CO2、SO2,该气体能使品红溶液褪色证明一定含SO2,原溶液中可能既含有SO32-又含有CO32-,故B正确;
C.碳原子位于周期表中第ⅥA主族不易得到或失去电子,形成化合物时主要是以共价键形成化合物,和同位素无关,故C错误;
D.石油是由多种烷烃和环烷烃组成的混合物,不含乙烯、丙烯和丁二烯,故乙烯、丙烯和丁二烯不是石油分馏的产物,故D错误.
故选B.
点评 本题考查了钠及其化合物性质、离子检验和反应现象、石油组成等知识点,主要是碳原子结构特征的理解应用,掌握基础是解题关键,题目难度中等.

| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | ①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液,若3种溶液pH均为9,则它们物质的量浓度大小顺序是①>②>③ |
| A. | Fe片 | B. | 蔗糖 | C. | 固体NaCl | D. | 熔融的CuCl2 |
①汽油和大豆油的成分是油脂
②葡萄糖(单糖)和麦芽糖(双糖)互为同系物
③煤油和煤焦油互为同分异构体
④乙醇、乙酸、乙酸乙酯都能发生取代反应
⑤乙醇可以用做燃料,也可以在医院里用做消毒剂
⑥除去溴苯中混有的溴可用四氯化碳
⑦淀粉、油脂、蛋白质在一定条件下都能发生水解反应.
| A. | ①②③⑦ | B. | ②④⑤⑦ | C. | ③④⑥⑦ | D. | ④⑤⑦ |

| A. | d为石墨,铁片腐蚀加快 | |
| B. | d为石墨,石墨上电极反应为:Na++e-═Na | |
| C. | d为锌块,铁片不易被腐蚀 | |
| D. | d为锌块,铁片上电极反应为:2H++2e-═H2↑ |
| A. | 溴苯(Br2):加水,萃取分液 | B. | SiO2(Fe2O3):足量的盐酸,过滤 | ||
| C. | Cl2(HCl):通过饱和氯化钠溶液 | D. | C2H5OH(CH3COOH):加足量CaO,蒸馏 |
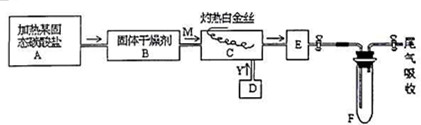
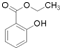 )广泛用于黑醋栗酒、依兰、百合等的花香型的调和香料,还用作草莓等果香香精及化工行业.水杨酸乙酯为无色油状液体,呈淡的冬青油香气,沸点233℃,溶于乙醇、乙醚,微溶于水和甘油.利用水杨酸(沸点:211℃)、乙醇(沸点:78.4℃)和浓硫酸在硫酸铝存在下于100℃下酯化而成,反应方程式如下:
)广泛用于黑醋栗酒、依兰、百合等的花香型的调和香料,还用作草莓等果香香精及化工行业.水杨酸乙酯为无色油状液体,呈淡的冬青油香气,沸点233℃,溶于乙醇、乙醚,微溶于水和甘油.利用水杨酸(沸点:211℃)、乙醇(沸点:78.4℃)和浓硫酸在硫酸铝存在下于100℃下酯化而成,反应方程式如下: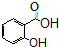 +C2H5OH?
+C2H5OH?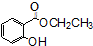 +H2O
+H2O