题目内容
5.由乙醇制取乙二酸乙二酯(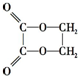 )时最合理的合成路线需经下列反应:
)时最合理的合成路线需经下列反应:①取代反应
②加成反应
③氧化反应
④还原反应
⑤消去反应
⑥酯化反应
下列有关合成乙二酸乙二酯的过程中反应类型的顺序正确的是( )
| A. | ①②③⑤⑥ | B. | ⑤②①③⑥ | C. | ⑥③①②⑤ | D. | ①②⑤③⑥ |
分析 乙二酸乙二酯由乙二酸和乙二醇发生酯化反应得到,乙醇发生消去反应生成乙烯,乙烯和溴反应生成1,2-二溴乙烷,1,2-二溴乙烷和NaOH的水溶液加热发生取代反应生成乙二醇,乙二醇被催化氧化生成乙二醛,乙二醛发生氧化反应生成乙二酸,据此分析解答.
解答 解:乙二酸乙二酯由乙二酸和乙二醇发生酯化反应得到,乙醇发生消去反应生成乙烯,乙烯和溴反应生成1,2-二溴乙烷,1,2-二溴乙烷和NaOH的水溶液加热发生取代反应生成乙二醇,乙二醇被催化氧化生成乙二醛,乙二醛发生氧化反应生成乙二酸,所以涉及的反应有:消去反应、加成反应、取代反应或水解反应、氧化反应、酯化反应或取代反应,合成乙二酸乙二酯的过程中反应类型的顺序为⑤②①③⑥,
故选B.
点评 本题以物质制备为载体考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,会根据官能团确定反应类型及反应条件,注意:水解反应、酯化反应都属于取代反应.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
15.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | ①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液,若3种溶液pH均为9,则它们物质的量浓度大小顺序是①>②>③ |
16.研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )


| A. | d为石墨,铁片腐蚀加快 | |
| B. | d为石墨,石墨上电极反应为:Na++e-═Na | |
| C. | d为锌块,铁片不易被腐蚀 | |
| D. | d为锌块,铁片上电极反应为:2H++2e-═H2↑ |
13.除去下列括号内杂质的试剂或方法错误的是( )
| A. | 溴苯(Br2):加水,萃取分液 | B. | SiO2(Fe2O3):足量的盐酸,过滤 | ||
| C. | Cl2(HCl):通过饱和氯化钠溶液 | D. | C2H5OH(CH3COOH):加足量CaO,蒸馏 |
20.某溶液中有NH4+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是( )
| A. | NH4+、Mg2+ | B. | Mg2+、Fe2+ | C. | NH4+、Fe2+ | D. | Mg2+、Al3+ |
10.有机化合物与人类的生活密切相关.以下叙述中,正确的是( )
①乙醇和乙酸都是常用调味品的主要成分 ②米酒变酸的过程涉及了氧化反应
③含磷合成洗涤剂易于被细菌分解,故不会导致水污染
④有机酸和醇脱水合成的某些酯,可用作糖果、化妆品中的香料
⑤用加酶洗衣粉洗涤毛织品效果更好.
①乙醇和乙酸都是常用调味品的主要成分 ②米酒变酸的过程涉及了氧化反应
③含磷合成洗涤剂易于被细菌分解,故不会导致水污染
④有机酸和醇脱水合成的某些酯,可用作糖果、化妆品中的香料
⑤用加酶洗衣粉洗涤毛织品效果更好.
| A. | ②③⑤ | B. | ①②④ | C. | ①②③ | D. | ①④⑤ |
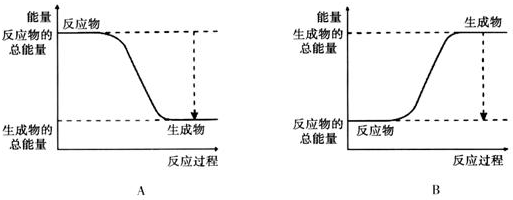
17.(1)已知2H2+O2═2H2O的反应反应为放热反应,如图能正确表示该反应中能量变化的是A(填编号).
(2)若从断键和成键的角度分析上述反应中能量的变化.化学键的键能如表:
则生成1mol水放出的热量为242kJ.

(2)若从断键和成键的角度分析上述反应中能量的变化.化学键的键能如表:
| 化学键 | H-H | O═O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
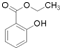 )广泛用于黑醋栗酒、依兰、百合等的花香型的调和香料,还用作草莓等果香香精及化工行业.水杨酸乙酯为无色油状液体,呈淡的冬青油香气,沸点233℃,溶于乙醇、乙醚,微溶于水和甘油.利用水杨酸(沸点:211℃)、乙醇(沸点:78.4℃)和浓硫酸在硫酸铝存在下于100℃下酯化而成,反应方程式如下:
)广泛用于黑醋栗酒、依兰、百合等的花香型的调和香料,还用作草莓等果香香精及化工行业.水杨酸乙酯为无色油状液体,呈淡的冬青油香气,沸点233℃,溶于乙醇、乙醚,微溶于水和甘油.利用水杨酸(沸点:211℃)、乙醇(沸点:78.4℃)和浓硫酸在硫酸铝存在下于100℃下酯化而成,反应方程式如下: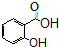 +C2H5OH?
+C2H5OH?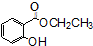 +H2O
+H2O
 .
.