题目内容
17.下列离子方程式或电极反应式书写正确的是( )| A. | Na2S溶液的水解:S2-+2H2O?H2S+2OH- | |
| B. | NaHCO3溶液的电离:HCO3-+H2O?H2 CO3+OH- | |
| C. | 钢铁发生吸氧腐蚀时,正极反应式:2H2O+O2+4e-=4OH- | |
| D. | 以石墨作电极,电解硫酸铜溶液,发生氧化反应的电极反应式:Cu-2e-=Cu2+ |
分析 A.硫离子的水解分步进行,主要以第一步为主,离子方程式写出第一步即可;
B.碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子;
C.钢铁发生吸氧腐蚀时,正极氧气得到电子生成氢氧根离子;
D.石墨为电解电解硫酸铜溶液,阳极氢氧根离子失去电子发生氧化反应生成氧气.
解答 解:A.Na2S是二元弱酸氢硫酸的盐,其水解分步进行,主要以第一步为主,正确的水解反应为:S2-+H2O?HS-+OH-,故A错误;
B.NaHCO3在溶液中完全电离出钠离子和碳酸氢根离子,正确的电离方程式为:NaHCO3=HCO3-+Na+,故B错误;
C.钢铁发生吸氧腐蚀时,负极铁失去电子,正极氧气得到电子,其正极反应式为:2H2O+O2+4e-=4OH-,故C正确;
D.以石墨作电极,电解硫酸铜溶液,阳极氢氧根离子失去电子被氧化生成氧气,则发生氧化反应的电极反应式为:4OH--4e-=2H2O+O2,故D错误;
故选C.
点评 本题考查较为综合,涉及盐的水解、电解质电离、电解原理、金属腐蚀等知识,为高考的高频题,题目难度中等,注意掌握盐的水解原理、电解原理及原电池工作原理,A为易错点,注意硫离子的水解分步进行,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
相关题目
8.下列各种说法中,正确的是( )
| A. | 某化合物电离时,生成的阳离子有氢离子的一定是酸 | |
| B. | 某化合物电离时,生成的阴离子有氢氧根离子的一定是碱 | |
| C. | 某化合物电离时,只生成了金属阳离子和酸根离子的一定是盐 | |
| D. | NH4Cl是一种盐,电离的电离方程式是:NH4Cl=NH4++Cl- |
5.有机物M是合成某药品的中间体,结构简式如图所示.下列说法错误的是( )
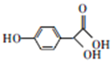

| A. | 用钠可检验M分子中存在羟基 | B. | M能发生酯化、加成、氧化反应 | ||
| C. | M的分子式为C8H8O4 | D. | M的苯环上一硝基代物有2种 |
12.不用任何试剂鉴别硫酸、硫酸钠、碳酸钠、氯化钡四种无色溶液,将它们两两混合现象如下:
由表可知:
( 1)B为BaCl2;C为Na2SO4(填化学式)
(2)要确定A、D还要进行的实验操作是:在A、D溶液中分别加入稀盐酸,若有生成气体现象,证明是Na2CO3(填化学式)
(3)写出A和D反应的离子方程式:CO32-+2H+=CO2↑+H2O.
| A | B | C | D | |
| A | -- | 白色沉淀 | 无现象 | 无色气体 |
| B | 白色沉淀 | -- | 白色沉淀 | 白色沉淀 |
| C | 无现象 | 白色沉淀 | -- | 无现象 |
| D | 无色气体 | 白色沉淀 | 无现象 | -- |
( 1)B为BaCl2;C为Na2SO4(填化学式)
(2)要确定A、D还要进行的实验操作是:在A、D溶液中分别加入稀盐酸,若有生成气体现象,证明是Na2CO3(填化学式)
(3)写出A和D反应的离子方程式:CO32-+2H+=CO2↑+H2O.
2.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 32 g O2中含有的分子数为NA | |
| B. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| C. | 1 mol Mg与足量O2反应转移的电子数为NA | |
| D. | 1 mol钠原子中含有的电子数为NA |
6.下列说法正确的是( )
| A. | 蛋白质、淀粉、硝化纤维、油脂都属于高分子化合物 | |
| B. | 聚丙烯能使溴水褪色 | |
| C. | 氯丁橡胶在空气中燃烧只生成CO2和H2O | |
| D. | 利用木材作原料制得的纤维是人造纤维 |
7.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④氯气的四氯化碳溶液 ⑤盐酸 ⑥盐酸与少量漂白粉的混合溶液.
①氯气 ②液氯 ③新制氯水 ④氯气的四氯化碳溶液 ⑤盐酸 ⑥盐酸与少量漂白粉的混合溶液.
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |