题目内容
2.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 32 g O2中含有的分子数为NA | |
| B. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| C. | 1 mol Mg与足量O2反应转移的电子数为NA | |
| D. | 1 mol钠原子中含有的电子数为NA |
分析 A、求出氧气的物质的量,然后根据分子个数N=nNA;
B、标况下水为液态;
C、镁反应后变为+2价;
D、钠含11个电子.
解答 解:A、32g氧气的物质的量为1mol,故分子个数N=nNA=NA个,故A正确;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、镁反应后变为+2价,故1mol镁失去2NA个电子,故C错误;
D、钠含11个电子,故1mol钠含有11NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
12.下列离子方程式中正确的是( )
| A. | 氯气溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 硫酸氢钠溶液与氢氧化钡溶液混合至混合液呈中性:2HSO4-+Ba2++2OH-=BaSO4↓+2H2O+SO42- | |
| C. | 向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 用铜作阳极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
10.能正确表示下列反应的离子方程式是( )
| A. | 醋酸钠的水解反应:CH3COO-+H2O═CH3COOH+OH- | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与过量二氧化碳反应:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3 Fe3++2NO↑+4H2O |
17.下列离子方程式或电极反应式书写正确的是( )
| A. | Na2S溶液的水解:S2-+2H2O?H2S+2OH- | |
| B. | NaHCO3溶液的电离:HCO3-+H2O?H2 CO3+OH- | |
| C. | 钢铁发生吸氧腐蚀时,正极反应式:2H2O+O2+4e-=4OH- | |
| D. | 以石墨作电极,电解硫酸铜溶液,发生氧化反应的电极反应式:Cu-2e-=Cu2+ |
7.纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因.假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的表面粒子数占总粒子数的百分比为( )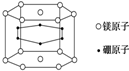

| A. | 22% | B. | 70% | C. | 66.7% | D. | 33.3% |
14.在 分子中,处于同一平面上的碳原子数最多可能有( )
分子中,处于同一平面上的碳原子数最多可能有( )
 分子中,处于同一平面上的碳原子数最多可能有( )
分子中,处于同一平面上的碳原子数最多可能有( )| A. | 6个 | B. | 8个 | C. | 10个 | D. | 12个 |
11.下列关于加热的操作正确的是( )
| A. | 给试管中的液体加热时,试管口不准对着别人,但可以对着自己 | |
| B. | 玻璃仪器都可以用于加热 | |
| C. | 在H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜 | |
| D. | 无论给试管中的液体还是固体加热,都必须先预热 |
12.经测定,某集气瓶中只含N和O两种元素,下列说法不正确的是( )
| A. | 集气瓶中所含物质可能是纯净物 | |
| B. | 集气瓶中可能只含有两种单质 | |
| C. | 集气瓶中不可能既存在单质又存在化合物 | |
| D. | 集气瓶中可能含有一种单质和一种化合物 |