题目内容
18.NA代表阿伏伽德罗常数的值,下列说法正确的是( )| A. | 0.1molCl2溶于足量水中,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
分析 A、氯气和水的反应为可逆反应;
B、标况下乙醇为液态;
C、16O2和18O2均为双原子分子;
D、在硫酸钠溶液中,阴离子除了硫酸根,还有氢氧根.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故A错误;
B、标况下乙醇为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、16O2和18O2均为双原子分子,故0.1mol混合物中含0.2mol氧原子即0.2NA个,与两者的比例无关,故C正确;
D、在硫酸钠溶液中,阴离子除了硫酸根,还有氢氧根,故溶液中阴离子所带的电荷数大于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
8.同一周期X、Y、Z三种短周期元素,它们的气态氢化物的化学式分别为H2X、YH3、ZH4,下列说法不正确的是( )
| A. | 气态氢化物的稳定性:H2X<YH3<ZH4 | |
| B. | 最高价氧化物对应的水化物酸性:H2XO4>H3YO4>H2ZO3 | |
| C. | 元素的最高正化合价:X>Y>Z | |
| D. | 元素原子的半径:X<Y<Z |
9.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 喝不含杂质的纯净水比喝矿泉水对人体更营养、更健康 | |
| B. | 维生素C具有较强还原性,熟吃新鲜蔬菜维生素C损失小 | |
| C. | 波尔多液是由硫酸铜溶液、生石灰和水制得,可用于防治植物的病虫害 | |
| D. | 亚硝酸钠具有强还原性而使肉类长时间保持鲜红,可在肉制食品中宜多加 |
13.下列用于解释事实的离子方程式书写正确的是( )
| A. | 铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+ | |
| B. | 硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- | |
| C. | 氯水具有漂白性:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ |
3.酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-.已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10. 下列说法正确的是( )
| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
8.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A,D元素同主族,B,C元素同周期;A,B,C,D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如表所示:
常温下,甲物质为气体,遇空气变为红褐色;乙物质为液体;丙物质和丁物质为固体,在丙和丁中,D元素均为+1价.请填写下列空白:
(1)乙物质的化学式为H2O2,丁物质中阴离子与阳离子的个数之比为1:2;
(2)自然界生成甲物质的反应的化学方程式为O2+N2$\frac{\underline{\;放电\;}}{\;}$2NO.
(3)丙与水反应制取某种气体时,发生反应的化学方程式为NaH+H2O=NaOH+H2↑.
(4)丁于水反应制取某种气体时,发生反应的化学方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)乙物质的化学式为H2O2,丁物质中阴离子与阳离子的个数之比为1:2;
(2)自然界生成甲物质的反应的化学方程式为O2+N2$\frac{\underline{\;放电\;}}{\;}$2NO.
(3)丙与水反应制取某种气体时,发生反应的化学方程式为NaH+H2O=NaOH+H2↑.
(4)丁于水反应制取某种气体时,发生反应的化学方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
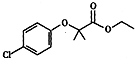
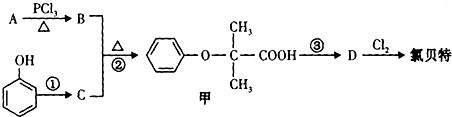
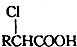

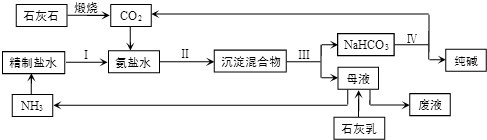
 ;
;