题目内容
15.同温同压下,相同质量的下列气体中,体积最大的是( )| A. | N2 | B. | SO2 | C. | Cl2 | D. | CO2 |
分析 同温同压下,相同质量的气体,其体积与摩尔质量成反比,摩尔质量越小,占有的体积越大.
解答 解:同温同压下,相同质量的气体,其体积与摩尔质量成反比,摩尔质量越小,占有的体积越大.
A.氮气的摩尔质量为28g/mol;
B.二氧化硫的摩尔质量为64g/mol;
C.氯气的摩尔质量为71g/mol;
D.二氧化碳的摩尔质量为44g/mol,
因此同温同压下,相同质量的气体,氮气的体积最大,
故选A.
点评 本题考查物质的量的有关计算、阿伏伽德罗定律及推论等,比较基础,注意基础知识理解掌握,题目难度不大.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
5.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78g苯含有C=C双键的数目为3NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 6.72L NO2与水充分反应转移的电子数目为0.2NA |
3.酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-.已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10. 下列说法正确的是( )
| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
20.质量反应的离子方程式书写正确的是( )
| A. | 氢氧化镁与稀盐酸反应:H++OH-═H2O | |
| B. | 氯化钡溶液与硫酸钠溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+ | |
| D. | 碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20 |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子数目为0.4NA | |
| C. | 1 L 1 mol?•L-1 FeCl3完全水解生成NA个胶体粒子 | |
| D. | 含2 mol H2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生NA个SO2气体分子 |
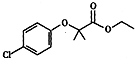
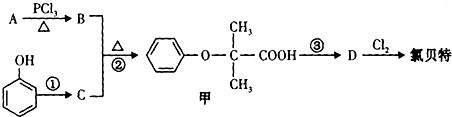
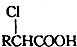

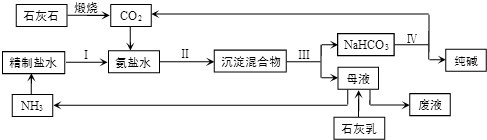
 ;
;