题目内容
12.铜是与人类关系密切的有色金属.已知:常温下,在溶液中Cu2+稳定,Cu2+易在酸性条件下发生反应2Cu+═Cu2++Cu.大多数+1价钢的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等.(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为砖红色,某同学实验时却有黑色物质出现,这黑色物质的化学式为CuO.
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:
a.2Cu2++4I-═2CuI2↓(白色)+I2,
b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2,
为顺利观察到白色沉淀可以加入的最佳试剂是B.
A.SO2 B.苯 C.NaOH溶液 D.乙醇
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH).
①已知NH5是离子化合物且所有原子都达到稀有气体的稳定结构,请写出NH5的电子式
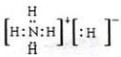 .
.②写出CuH在过量稀盐酸中有气体生成的离子方程式2CuH+2H+=Cu2++Cu+2H2↑.
③将CuH溶解在适量的稀硝酸中,完成下列化学方程式.6CuH+16HNO3═6Cu(NO3)2+3H2↑+4NO+8H2O.
(4)常温下,向0.20mol•L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH=6时,c(Cu2+)=2.2×10-4.[已知:Ksp[Cu(OH)2]=2.2×10-20].
分析 (1)葡萄糖分子中含有醛基,和新制氢氧化铜浊液加热反应生成砖红色沉淀Cu2O,黑色的物质的产生源于加热温度过高;
(2)通过查询CuI2和CuCl的Ksp可以判断出那种沉淀更难溶,碘水的颜色影响白色沉淀的观察,可以选用萃取剂把碘萃取出来;
(3)①NH5在所有原子都达到稀有气体的稳定结构,说明NH5是由NH4+和H-组成的离子化合物;
②CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,产生的气体为氢气,在酸性溶液中2Cu+=Cu2++Cu.
③Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O;
(4)pH=6时,c(OH-)=10-8mol•L?1,结合Ksp[Cu(OH)2]计算.
解答 解:(1)葡糖糖是一个多羟基醛,能与新制氢氧化铜浊液加热反应生成砖红色沉淀Cu2O,如果加热温度过高,氢氧化铜受热分解为黑色的氧化铜和水,
故答案为:砖红色;CuO;
(2)碘水是棕褐色的影响白色沉淀的观察,可以用四氯化碳把碘单质萃取出来,由于酒精与水以任意比例混溶,因此不能做萃取剂,
故答案为:B;
(3)①NH5在所有原子都达到稀有气体的稳定结构,即氮原子最外层达到8电子稳定结构,所有氢原子达到2电子稳定结构,说明NH5是由NH4+和H-组成的离子化合物,电子式为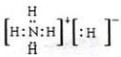 ,
,
故答案为: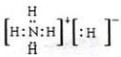 ;
;
②CuH溶解在稀盐酸中,CuH中的H-失电子盐酸中H+得电子,产生的气体为氢气,酸性溶液中2Cu+=Cu2++Cu,故离子方程式为:2CuH+2H+=Cu2++Cu+2H2↑
故答案为:2CuH+2H+=Cu2++Cu+2H2↑;
③Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能把铜氧化为硝酸铜,CuH具有还原性,因此二者反应生成氢气、一氧化氮气体、铜离子、H2O,其化学方程式为:6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
故答案为:6;16;6;3;4;NO;8;H2O;
(4)pH=6时,c(OH-)=10-8mol•L?1,由Ksp[Cu(OH)2]=2.2×10-20mol3•L-3可知,c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{-8})}$=2.2×10-4mol•L?1,故答案为:2.2×10-4.
点评 本题考查较综合,涉及物质的性质、氧化还原反应及Ksp计算等,注重化学反应原理的考查,把握习题中的信息及迁移应用能力为解答的关键,题目难度不大.

| A. | 相对原子质量和电子数 | B. | 电子层数和最外层电子数 | ||
| C. | 电子层数和次外层电子数 | D. | 相对原子质量和最外层电子数 |
| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
| A. | 氢氧化镁与稀盐酸反应:H++OH-═H2O | |
| B. | 氯化钡溶液与硫酸钠溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+ | |
| D. | 碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20 |
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子数目为0.4NA | |
| C. | 1 L 1 mol?•L-1 FeCl3完全水解生成NA个胶体粒子 | |
| D. | 含2 mol H2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生NA个SO2气体分子 |
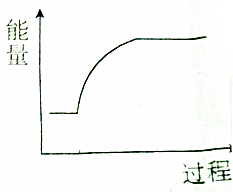
| A. | 钠与水反应 | B. | 钠的熔化过程 | ||
| C. | 氢氧化钠溶液与稀盐酸反应 | D. | Na2O2+H2O→NaOH+O2(未配平) |
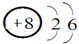 ;
; .
.
 B.11.2L C.14.0L D.16.8L
B.11.2L C.14.0L D.16.8L