题目内容
16.某固体A在一定条件下可完全分解,生成B、C、D三种气体的混合物.反应方程式如下:2A═B↑+2C↑+3D↑.此时测得混合气体的相对平均分子质量为30,则固体A的摩尔质量为( )| A. | 30g/mol | B. | 60g/mol | C. | 90g/mol | D. | 120g/mol |
分析 设A为2mol,由方程式可知分解生成6mol气体,根据m=nM计算混合气体质量,根据质量守恒定律可得A的质量,再根据M=$\frac{m}{n}$计算A的摩尔质量.
解答 解:设A为2mol,由方程式2A═B↑+2C↑+3D↑,可知分解生成6mol气体,则混合气体质量为6mol×30g/mol=180g,根据质量守恒定律可得A的质量为180g,故A的摩尔质量为$\frac{180g}{2mol}$=90g/mol,
故选:C.
点评 本题考查化学方程式计算,难度不大,注意利用赋值法简化计算,侧重考查学生分析计算能力.

练习册系列答案
相关题目
7.下列变化中不可能通过一步完成的是( )
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Na2O2→NaOH | D. | Na2CO3→NaHCO3 |
4.下列各组稀溶液,只用试管和胶头滴管无法鉴别的是( )
| A. | Na2CO3和H2SO4 | B. | NaAlO2和HCl | C. | Na2CO3和Ca(OH)2 | D. | KAl(SO4)2和NaOH |
11.下列反应能用离子方程式:H++OH-═H2O.表示的是( )
| A. | HNO3+KOH═KNO3+H2O | B. | 2HCl+Cu(OH)2═CuCl2+2H2O | ||
| C. | CH3COOH+NaOH═CH3COONa+H2O | D. | HCl+NH3•H2O═NH4Cl+H2O |
1.下列离子方程式书写正确的是( )
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 硝酸钾溶液与稀硫酸反应:NO3-+H+═HNO3 | |
| C. | 铁与硫酸铜溶液反应:2Fe+3Cu2+═2Fe3++3Cu | |
| D. | 碳酸钠溶液与稀硫酸反应:2H++CO32-═H2O+CO2↑ |
5.为除去氯化铜中混有的氯化亚铁得到纯净的氯化铜溶液,常先加入H2O2溶液将Fe2+全部氧化成Fe3+,然后再加入( )
| A. | NaOH溶液 | B. | 氨水 | C. | CuO | D. | KSCN溶液 |
1.室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )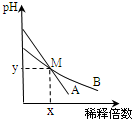

| A. | 取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同 | |
| B. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7 | |
| C. | 稀释前两溶液中H+浓度的大小关系:A=10B | |
| D. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L |
 .
.