题目内容
11.下列反应能用离子方程式:H++OH-═H2O.表示的是( )| A. | HNO3+KOH═KNO3+H2O | B. | 2HCl+Cu(OH)2═CuCl2+2H2O | ||
| C. | CH3COOH+NaOH═CH3COONa+H2O | D. | HCl+NH3•H2O═NH4Cl+H2O |
分析 强酸与强碱反应生成可溶性盐和水的离子反应能用离子方程式H++OH-═H2O表示,如:酸不能为醋酸,碱不能为氨水、氢氧化铜等,以此来解答.
解答 解:A.HNO3+KOH═KNO3+H2O的离子方程式为:H++OH-═H2O,故A正确;
B.2HCl+Cu(OH)2═CuCl2+2H2O中氢氧化铜不能拆开,其离子方程式为Cu(OH)2+2H+═2H2O+Cu2+,不能用H++OH-═H2O表示,故B错误;
C.CH3COOH为弱酸,离子方程式中不能拆开,其离子方程式为:CH3COOH+NaOH═CH3COONa+H2O,不能用H++OH-═H2O表示,故C错误;
D.HCl+NH3•H2O═NH4Cl+H2O的离子方程式为NH3•H2O+H+=NH4++H2O,不能用H++OH-═H2O表示,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意物质的溶解性及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
1.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
6.用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 100g质量分数为98%的浓硫酸中所含氧原子数为4NA | |
| C. | 常温常压下,92gNO2N2O4的混合气体含有的原子数为6NA | |
| D. | 44gN2O和CO2组成的混合气体中含有NA个分子 |
16.某固体A在一定条件下可完全分解,生成B、C、D三种气体的混合物.反应方程式如下:2A═B↑+2C↑+3D↑.此时测得混合气体的相对平均分子质量为30,则固体A的摩尔质量为( )
| A. | 30g/mol | B. | 60g/mol | C. | 90g/mol | D. | 120g/mol |
3.已知一个某原子的质量是M g,则该原子的摩尔质量是( )
| A. | M•NA | B. | Mg/mol | C. | $\frac{M}{{N}_{A}}$g/mol | D. | M•NA g/mol |
20.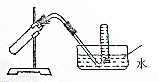 如图装置可用于( )
如图装置可用于( )
 如图装置可用于( )
如图装置可用于( )| A. | 加热NaHCO3制CO2 | B. | 用Cu和稀HNO3反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用NaCl于浓H2SO4反应制HCl |