题目内容
1.室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )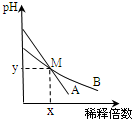
| A. | 取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同 | |
| B. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7 | |
| C. | 稀释前两溶液中H+浓度的大小关系:A=10B | |
| D. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L |
分析 根据图象可知,室温下,pH相差1的两种一元碱溶液A和B,稀释相同倍数后溶液的pH相等,根据图知,A的pH变化较大,B的变化较小,pH变化大的碱碱性较强,所以碱性A>B;
A.M点pH相同,则两种溶液中c(OH-)相同,碱性A>B,所以浓度c(A)<c(B),取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗V(H2SO4)与碱的物质的量成正比;
B.A的碱性大于B,A可能是强碱也可能是弱碱,醋酸与A恰好中和时生成的盐可能是强碱弱酸盐、可能是弱酸弱碱盐;
C.稀释前A溶液中氢氧根离子浓度为B的10倍,则氢离子浓度为B的0.1倍;
D.碱电离出的氢氧根离子抑制了水的电离.
解答 解:根据图象可知,室温下,pH相差1的两种一元碱溶液A和B,稀释相同倍数后溶液的pH相等,根据图知,A的pH变化较大,B的变化较小,pH变化大的碱碱性较强,所以碱性A>B;
A.M点pH相同,则两种溶液中c(OH-)相同,碱性A>B,所以浓度c(A)<c(B),取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗V(H2SO4)与碱的物质的量成正比,相同pH、相同体积的n(A)<n(B),所以消耗相同浓度的V(H2SO4)为A<B,故A错误;
B.A的碱性大于B,A可能是强碱也可能是弱碱,醋酸与A恰好中和时生成的盐可能是强碱弱酸盐、可能是弱酸弱碱盐,如果是强碱弱酸盐,溶液呈碱性,如果是弱酸弱碱盐,要根据弱酸弱碱的相对强弱判断溶液酸碱性,所以用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7,故B正确;
C.稀释前A溶液的pH比B大1,则A溶液中的氢氧根离子浓度为B的10倍,而A溶液中氢离子浓度应该为B的0.1倍,即:稀释前两溶液中H+浓度的大小关系:10A=B,故C错误;
D.碱溶液抑制了水的电离,则稀释前A溶液中由水电离出的OH-的浓度小于10-7 mol/L,故D错误;
故选B.
点评 本题考查电解质在水中的电离及图象,明确图象中pH的变化及交点的意义是解答本题的关键,难点是判断两种碱的相对强弱,题目难度中等.

 优等生题库系列答案
优等生题库系列答案| A. | 30g/mol | B. | 60g/mol | C. | 90g/mol | D. | 120g/mol |
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 漂白粉溶液中通入足量二氧化硫气体:ClO-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| C. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
| A. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$Na2CO3 | |
| B. | Fe2SO4$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2溶液$\stackrel{足量CO_{2}}{→}$Al(OH)3 | |
| D. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A. | 0.8g | B. | 1.6g | C. | 2.4g | D. | 3.2g |
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7Ka2=5.6×10-11 |
| A. | 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(CH3COO-) | |
| B. | 常温下,已知酸H2A存在如下平衡:H2A═H++HA-;HA-═H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5 |