题目内容
2.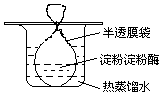 把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.(1)淀粉在实验中发生反应的化学反应方程式:(C6H10O5)n+nH2O$\stackrel{酶}{→}$nC6H12O6 ,
(2)取烧杯中的溶液少许滴入新制Cu(OH)2悬浊液中加热煮沸,观察到的现象是有砖红色沉淀生成.
(3)取半透膜袋中的液体少许于试管中,加入碘水,观察到变蓝现象,则说明淀粉在这段时间内未水解完全.
分析 (1)淀粉在淀粉酶的作用下发生水解生成葡萄糖;
(2)淀粉在淀粉酶的作用下发生水解生成葡萄糖,葡萄糖含有醛基,遇新制Cu(OH)2悬浊液中加热煮沸会生成砖红色的氧化亚铜沉淀;
(3)根据淀粉与碘水变蓝检验判断.
解答 解:(1)淀粉在淀粉酶的作用下发生水解生成葡萄糖,方程式为:(C6H10O5)n+nH2O$\stackrel{酶}{→}$nC6H12O6 ,故答案为:(C6H10O5)n+nH2O$\stackrel{酶}{→}$nC6H12O6 ;
(2)淀粉在淀粉酶的作用下发生水解生成葡萄糖,葡萄糖含有醛基,遇新制Cu(OH)2悬浊液中加热煮沸会生成砖红色的氧化亚铜沉淀,所以观察到的现象是有砖红色沉淀生成,故答案为:有砖红色沉淀生成;
(3)证明半透膜袋中的液体中含淀粉,实验方法为取半透膜袋中的液体少量滴加碘水,溶液变蓝,
故答案为:碘水;变蓝.
点评 本题考查物质的检验和鉴别,为高考常见题型,侧重于元素化合物知识及实验结合的应用,注意把握相关物质的性质及常见离子的检验方法,题目难度不大.

练习册系列答案
相关题目
13.常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如表所示:
(1)Ba(OH)2溶液的物质的量浓度为?
(2)x的值是多少?
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时溶液的pH为多少?(已知lg2=0.3)
| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 13 |
| ② | 22.00 | 18.00 | 12 |
| ③ | 22.00 | 22.00 | 7 |
(2)x的值是多少?
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时溶液的pH为多少?(已知lg2=0.3)
14.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3═2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 4:5 |
11.下列事实不能用勒夏特列原理解释的是( )
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| C. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
1.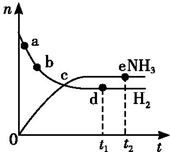 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )| A. | c点表示NH3生成速率与NH3分解速率相等 | |
| B. | c点和e点H2的转化率相等 | |
| C. | 平衡后再升高温度,不利于氨的合成 | |
| D. | d点时:n(H2):n(NH3)=3:2 |