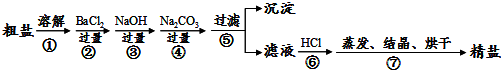
题目内容
13.常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如表所示:| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 13 |
| ② | 22.00 | 18.00 | 12 |
| ③ | 22.00 | 22.00 | 7 |
(2)x的值是多少?
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时溶液的pH为多少?(已知lg2=0.3)
分析 (1)根据①知,Ba(OH)2溶液中未加稀盐酸时,溶液的pH=13,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L,根据OH-守恒计算c[Ba(OH)2];
(2)根据③知,相同体积的氢氧化钡和稀盐酸混合时,混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-),因为体积相同,所以酸中c(H+)等于碱中c(OH-);
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时,Ba(OH)2、NaHCO3的物质的量之比为1:1,二者反应生成碳酸钡沉淀、水和NaOH,n(NaOH)=n(NaHCO3),再计算c(NaOH)及溶液的pH.
解答 解:(1)根据①知,Ba(OH)2溶液中未加稀盐酸时,溶液的pH=13,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L,根据OH-守恒计算c[Ba(OH)2]=$\frac{1}{2}$×c(OH-)=$\frac{1}{2}$×0.1mol/L=0.05mol/L,
答:氢氧化钡物质的量浓度为0.05mol/L;
(2)根据③知,相同体积的氢氧化钡和稀盐酸混合时,混合溶液呈中性,说明酸中n(H+)等于碱中n(OH-),因为体积相同,所以酸中c(H+)等于碱中c(OH-)为0.1mol/L,所以x=1,答:x值为1;
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时,Ba(OH)2、NaHCO3的物质的量之比为1:1,二者反应生成碳酸钡沉淀、水和NaOH,设碳酸氢钠的体积为xL,则0.05mol/L×0.1L=0.05mol/L×xL,x=0.1,混合溶液中n(NaOH)=n(NaHCO3)=0.05mol/L×0.1L=0.005mol,c(NaOH)=$\frac{0.005mol}{0.2L}$=0.025mol/L,溶液中c(H+)=$\frac{1{0}^{-14}}{0.025}$mol/L=4×10-13 mol/L,溶液的pH=-lgc(H+)=-lg4×10-13=12.4,
答:混合溶液的pH为12.4.
点评 本题考查酸碱混合溶液定性判断及溶液pH值的计算,为高频考点,侧重考查学生分析计算能力,难点是(3)题计算,正确判断沉淀最大时消耗碳酸氢钠溶液体积是解此题关键,注意原子守恒的灵活运用,题目难度中等.

| A. | 煤的主要成分是焦炭和无机物杂质 | |
| B. | 用家用汽车代替公交车不能达到节能减排的目的 | |
| C. | 汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾 | |
| D. | 添加三聚氰胺能增加奶制品的N元素含量,但是对人体有害 |
| A. | K+、Na+、MnO4-、SO42- | B. | Fe3+、Na+、HCO3-、Cl- | ||
| C. | K+、Cu2+、S2-、SO42- | D. | Na+、K+、OH-、AlO2- |
| A. | 少量白磷保存在冷水中 | B. | 氢氧化钠固体敞口放在空气中 | ||
| C. | 生石灰露置于空气中 | D. | 浓盐酸盛放在敞口玻璃瓶中 |
| A. | 羟基和氢氧根离子有相同的化学式和结构式 | |
| B. | 乙醇的官能团是羟基 | |
| C. | NaOH中含有羟基 | |
| D. | 乙醇与钠反应中,羟基被取代 |
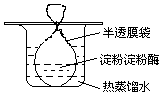 把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.