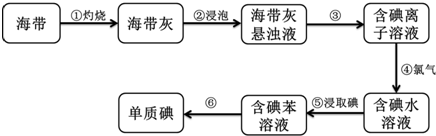
题目内容
10.某固体混合物可能含有CaCO3、MgCl2、Na2SO4、Ba(NO3)2和CuSO4中的一种或几种,将该混合物进行如下实验:①将少许混合物放入水中得到无色溶液和白色沉淀,过滤;
②取溶液进行焰色反应,火焰呈黄色;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体.
由上述现象推断:
(1)该混合物中一定含有CaCO3、Na2SO4;一定不含有Ba(NO3)2、CuSO4,可能含有MgCl2;
(2)若要检验可能含有的物质是否存在,可以采用的实验操作为BC(填写字母).
A.取步骤①中滤液,加入AgNO3溶液,再加稀硝酸
B.取步骤①中滤液,加入NaOH溶液
C.取步骤①中滤液,加入足量Ba(NO3)2溶液,静置后在上层清液中加入酸化AgNO3溶液
D.取步骤①中滤液,加入足量BaCl2溶液,静置后在上层清液中加入酸化AgNO3溶液.
分析 ①将少许混合物放入水中得到无色溶液和白色沉淀,过滤,则一定不含CuSO4,白色沉淀为碳酸钙或硫酸钡;
②取溶液进行焰色反应,火焰呈黄色,则一定含Na2SO4;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体,可知白色沉淀只能为CaCO3,不含硫酸钡,则一定不存在Ba(NO3)2,无法确定的存在MgCl2,以此来解答.
解答 解:①将少许混合物放入水中得到无色溶液和白色沉淀,过滤,则一定不含CuSO4,白色沉淀为碳酸钙或硫酸钡;
②取溶液进行焰色反应,火焰呈黄色,则一定含Na2SO4;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体,可知白色沉淀只能为CaCO3,不含硫酸钡,则一定不存在Ba(NO3)2,无法确定的存在MgCl2,
(1)综上所述,一定含有CaCO3、Na2SO4,一定不含有Ba(NO3)2、CuSO4,可能有MgCl2,
故答案为:CaCO3、Na2SO4;Ba(NO3)2、CuSO4;MgCl2;
(2)A.取步骤①中滤液,加入AgNO3溶液,再加稀硝酸,白色沉淀可能为硫酸银或AgCl,不能检验,故A不选;
B.取步骤①中滤液,加入NaOH溶液,白色沉淀为氢氧化镁,可鉴别,故B选;
C.取步骤①中滤液,加入足量Ba(NO3)2溶液,除去硫酸根离子,静置后在上层清液中加入酸化AgNO3溶液,白色沉淀为AgCl,可鉴别,故C选;
D.取步骤①中滤液,加入足量BaCl2溶液,白色沉淀为硫酸钡,且引人氯离子,静置后在上层清液中加入酸化AgNO3溶液,不能鉴别,故D不选;
故答案为:BC.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及现象推断物质为解答的关键,侧重分析与推断能力的考查,注意沉淀及离子检验的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.测定结晶水合物中结晶水含量时,不需要的仪器是( )
| A. | 玻璃棒 | B. | 干燥器 | C. | 坩埚钳 | D. | 烧杯 |
1.下列物质的保存方法正确的是( )
| A. | 少量白磷保存在冷水中 | B. | 氢氧化钠固体敞口放在空气中 | ||
| C. | 生石灰露置于空气中 | D. | 浓盐酸盛放在敞口玻璃瓶中 |
15.根据下列各题所给出的数据,得出的结论正确的是( )
| A. | 通入标准状况下HCl气体11.2L,可使1 L浓度为0.5mol/L的盐酸物质的量浓度增大到1mol/L | |
| B. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OH- | |
| C. | 将10g碳酸钙粉末加水配成100mL溶液,CaCO3物质的量浓度为1mol/L | |
| D. | 4g NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为0.1mol•L-1 |
19.下列实验操作中,正确的是( )
| A. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| B. | 不能用燃着的酒精灯去点燃另一酒精灯 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 加完药品后应将滴管洗净后再放回原瓶 |
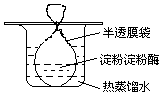 把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.