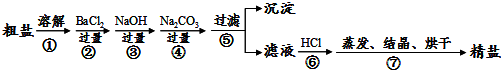
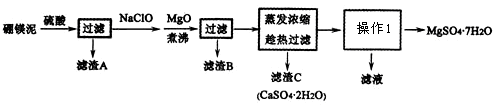
题目内容
14.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3═2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为( )| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 4:5 |
分析 在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为0价,被氧化;氮元素由硝酸根中+5价降低为0价,被还原,氮气既是还原产物也是氧化产物,根据电子转移守恒,判断被氧化的氮原子与被还原的氮原子物质的量之比.
解答 解:在5NH4NO3═2HNO3+4N2↑+9H2O的反应中,氮元素由铵根中-3价升高为0价,被氧化,
氮元素由硝酸根中+5价降低为0价,被还原,氮气既是还原产物也是氧化产物,
根据电子转移守恒,可知被氧化的氮原子与被还原的氮原子物质的量之比为(5-0):[0-(-3)]=5:3.
故选A.
点评 本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价变化判断氧化剂与还原剂,再根据电子转移守恒判断被氧化的氮原子与被还原的氮原子物质的量之比.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.有一学生欲配制下列无色透明溶液,其中可能实现的是( )
| A. | K+、Na+、MnO4-、SO42- | B. | Fe3+、Na+、HCO3-、Cl- | ||
| C. | K+、Cu2+、S2-、SO42- | D. | Na+、K+、OH-、AlO2- |
9.下列反应的离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 稀硫酸与Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | 稀硝酸滴在大理石上:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 氧化铁与稀盐酸混合:Fe2O3+6H+═2Fe3++3H2O |
19.下列实验操作中,正确的是( )
| A. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| B. | 不能用燃着的酒精灯去点燃另一酒精灯 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 加完药品后应将滴管洗净后再放回原瓶 |
6.“纳米材料”是指直径在几纳米到几十纳米的材料.如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是( )
| A. | 能全部透过半透膜 | B. | 所得物质一定为悬浊液或乳浊液 | ||
| C. | 所得混合物一定能导电 | D. | 有丁达尔效应 |
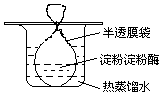 把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.