题目内容
3.某化学探究小组用如下实验证明了烧碱与稀硫酸能发生中和反应.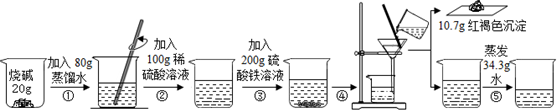
②③两步均充分反应,加入硫酸铁溶液,立即产生明显现象,最终得到只含一种溶质的无色溶液.请回答下列问题:
(1)根据发生的反应及现象可知反应②结束时溶液中的离子有Na+、OH-、SO42-(填离子符号);②无明显现象,发生反应的化学方程式是H2SO4+2NaOH=Na2SO4+2H2O;
(2)求解③中参加反应的烧碱的质量为12g;
(3)发生中和反应的硫酸的物质的量为0.1mol;
(4)最终得到的无色不饱和溶液只含一种溶质,则所得溶液中溶质的质量分数为10%.
分析 (1)根据发生的反应及现象判断溶液中含有的离子;氢氧化钠与硫酸反应生成硫酸钠和水,据此书写方程式;
(2)设③中参加反应的烧碱的质量为x,反应生成硫酸钠质量为y,依据6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4计算解答;
(3)依据方程式:2NaOH+H2SO4═Na2SO4+2H2O计算;
(4)根据质量分数公式:ω=$\frac{溶质的质量}{溶液的质量}$×100%,求所得溶液中溶质的质量分数.
解答 解:(1)根据发生的反应及现象可知反应②结束时溶液中的离子有过量氢氧化钠中的钠离子和氢氧根离子及其反应生成的硫酸钠中的钠离子和硫酸根离子;
氢氧化钠和稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O.
故答案为:Na+、OH-、SO42-;2NaOH+H2SO4═Na2SO4+2H2O;
(2)设③中参加反应的烧碱的质量为x,反应生成硫酸钠质量为y,
6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4,
240 214 426
x 10.7g y
$\frac{240}{x}$ $\frac{214}{10.7}$ $\frac{426}{y}$
x=12g,y=21.3g,
故答案为:12g;
(3)设发生中和反应的硫酸的质量为z,生成硫酸钠质量为m,
2NaOH+H2SO4═Na2SO4+2H2O,
80 98 142
20g-12g z m
$\frac{80}{142}$=$\frac{8g}{z}$ z=14.2g; $\frac{98}{80}$=$\frac{m}{8}$ m=9.8g;n(H2SO4)=$\frac{9.8g}{98g/mol}$=0.1mol;
故答案为:0.1mol;
(4)因此最终得到的无色不饱和溶液中溶质的质量分数=$\frac{21.3g+14.2g}{20g+80g+100g+200g-10.7g-34.3g}$=10%;
故答案为:10%.
点评 本题考查了有关方程式的计算,熟悉发生的化学反应,明确相关物质的性质是解题关键,题目难度不大.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 | |
| B. | 工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关 | |
| C. | 以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
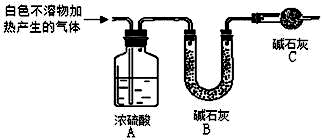
(1)提出假设:
猜测1:白色不溶物可能为Mg(OH)2.
猜测2:白色不溶物可能为MgCO3猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
(2)定性实验:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入足量的滴有酚酞的饱和NaHCO3溶液中,充分反应后过滤 | 产生较多气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧,火焰呈淡蓝色 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | ②产生气泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③CaCl2或BaCl2 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- |
(3)定量实验:
称取干燥、纯净的白色不溶物 14.2g,充分加热至不再产生气体为止,并使分解产生的气体全部进入如图装置中.实验后装置A 增重1.8g,装置B 增重4.4g.装置C 的作用是;若移除装置C 会导致x/y 的值偏大.
(填“偏大”、“偏小”或“不变”).?写出镁与饱和碳酸氢钠溶液反应的化学方程式3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
| A. | 一定是一种单质 | B. | 可能是化合物 | ||
| C. | 一定是纯净物 | D. | 可能是纯净物,也可能是混合物 |
| A. | 水中 | B. | CCl4中 | C. | 敞口容器中 | D. | 煤油中 |
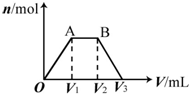 有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
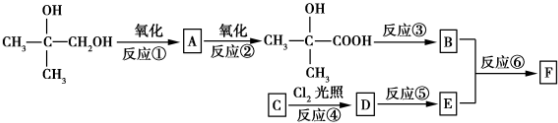
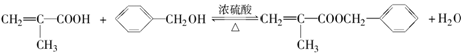 .
.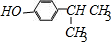 .
.