题目内容
13.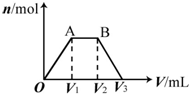 有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
分析 向KOH和Ca(OH)2的混合稀溶液中通入CO2,先二氧化碳和氢氧化钙反应生成碳酸钙沉淀,当氢氧化钙消耗完时,继续通入二氧化碳,二氧化碳和氢氧化钾反应生成碳酸钾,当氢氧化钾完全反应后,继续通入二氧化碳,二氧化碳和碳酸钾、水反应生成碳酸氢钾,当碳酸钾反应后,继续通入二氧化碳,二氧化碳和和碳酸钙、水反应生成可溶性的碳酸氢钙,然后根据相同条件下体积之比等于物质的量之比来解答.
解答 解:有KOH和Ca(OH)2的混合溶液,pH=13,即氢氧根离子的浓度是0.1mol/L,取此溶液500mL,氢氧根离子的物质的量是0.05mol,OA段:Ca2++2OH-+CO2═CaCO3↓+H2O消耗112mL即0.005mol的二氧化碳,所以钙离子的物质的量是0.005mol,产生碳酸钙沉淀是0.005mol,消耗了氢氧根离子是0.01mol,所以氢氧化钾中氢氧根离子的物质的量是0.04mol,AB段:2OH-+CO2═CO32-+H2O,消耗二氧化碳是0.02mol,体积是0.448L,即448mL,V1为112mL,所以V2为560mL,B-最后段:CO32-+H2O+CO2═2HCO3-,同时碳酸钙溶解,消耗二氧化碳体积和OA段相等,即112mL,V3的体积是672mL,
故选A.
点评 本题考查学生物质的性质,注意结合图象来理解是关键,难度不大.

练习册系列答案
相关题目
1.下列有关说法正确的是( )
| A. | 氨水稀释后,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| D. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 |
8.用惰性电极电解100mL含c(H+)=0.30mol•L-1下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Mg(NO3)2溶液 |
2.设NA表示阿伏加德罗常数,下列说法中错误的是( )
| A. | 142g氯气中含Cl2的分子数为2NA | |
| B. | 1.7gOH-中所含电子的数目为NA | |
| C. | 49g硫酸中所含氧原子的数目为2NA | |
| D. | 71g硫酸钠中所含钠离子的数目为2NA |
2. 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )| A. | 从N→M:先向N中加入适量固体A再降温 | |
| B. | 从N→M:先将N降温再加入适量固体A | |
| C. | 从M→N:先将M降温再将其升温 | |
| D. | 从M→N:先将M升温再将其蒸发掉部分水 |
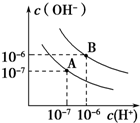 已知水在25℃和95℃时,其电离平衡曲线如图所示:
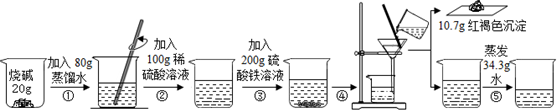
已知水在25℃和95℃时,其电离平衡曲线如图所示: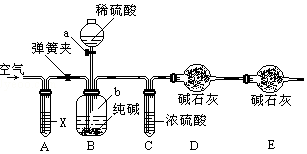 某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下: