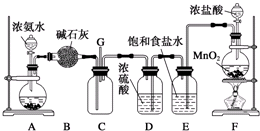
题目内容
8.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4$\frac{\underline{\;\;△\;\;}}{\;}$27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
(2)用离子方程式表示除去固体产物中Al2O3的原理Al2O3+2OH-=2AlO2-+H2O;
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理MgO+2NH4Cl+H2O=MgCl2+2NH3•H2O.
分析 (1)分解反应是吸热反应且生成的氧化镁、氧化铝的熔点高;
(2)氧化镁是碱性氧化物,氧化铝是两性氧化物,依据二者性质不同除去;
(3)氯化铵溶液中铵根离子水解溶液显酸性,氧化镁溶于酸促进水解平衡正向进行.
解答 解:(1)2Mg5Al3(OH)19(H2O)4$\frac{\underline{\;\;△\;\;}}{\;}$27H2O↑+10MgO+3Al2O3 ,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气.
故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
(2)氧化镁是碱性氧化物溶于酸,氧化铝是两性氧化物溶于酸、溶于碱,加入氢氧化钠溶解后过滤除去,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)氯化铵溶液中铵根离子水解溶液显酸性,氧化镁溶于水解生成的酸,反应的化学方程式为:MgO+2NH4Cl+H2O=MgCl2+2NH3•H2O,
故答案为:MgO+2NH4Cl+H2O=MgCl2+2NH3•H2O.
点评 本题考查了镁铝化合物性质,盐类水解的原理应用,主要是氧化镁、氧化铝性质的熟练掌握,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列选用的仪器和药品能达到实验目的是( )
| A | B | C | D |
 | 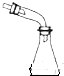 | 饱和NaHSO3溶液 |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 除去SO2中的少量HCl | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
13.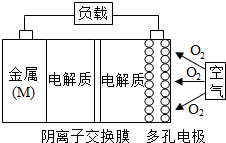 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 比较Mg,Al,Zn三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| C. | M-空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne-=4M(OH)n | |
| D. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
20.大气中CO2含量的增加会加剧“温室效应”.下列活动会导致大气中CO2含量增加的是( )
| A. | 燃烧煤炭供热 | B. | 利用风力发电 | C. | 增加植被面积 | D. | 节约用电用水 |
3.下列生活中的化学的说法,不正确的是( )
| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
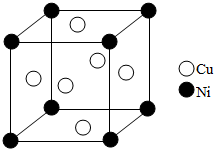 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: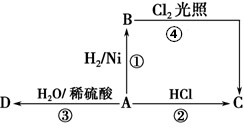
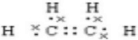 ;D的结构简式为CH3CH2OH.
;D的结构简式为CH3CH2OH.