题目内容
5.下列说法正确的是( )| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol•L-1Na2CO3溶液加热后,溶液的pH减小 | |
| C. | 常温常压下,22.4LCl2中含有的分子数为6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1CH3COOH溶液,溶液的导电能力增强 |
分析 A、氢氧燃料电池中,H2在负极上失去电子;
B、加热促进碳酸根离子的水解,使得氢氧根离子浓度增大;
C、不是标准状况,不能用公式计算气体的物质的量;
D、电解质的导电能力与溶液中自由移动阴阳离子的浓度有关.
解答 解:A、氢氧燃料电池中,H2在负极上失去电子被氧化,故A正确;
B、Na2CO3溶液加热,促进碳酸根离子的水解,使得氢氧根离子浓度增大,溶液的pH增大,故B错误;
C、常温常压,不是标准状况,22.4LCl2中,不能用公式计算气体的物质的量,故C错误;
D、电解质的导电能力与溶液中自由移动阴阳离子的浓度有关,稀释0.1mol•L-1CH3COOH溶液,使得离子浓度减小,导电能力减弱,故D错误.
故选A.
点评 本题考查了原电池基本原理、盐类水解的影响因素、NA的计算和导电能力强弱的判断,综合性强,但是较为基础,掌握基本原理是解题的关键,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
7.NA表示阿伏加罗常数的值,下列说法正确的是( )
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有的氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L0.5mol/L CH3COOH溶液中含有的H+数为0.05NA |
16.下列选用的仪器和药品能达到实验目的是( )
| A | B | C | D |
 | 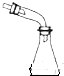 | 饱和NaHSO3溶液 |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 除去SO2中的少量HCl | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
13.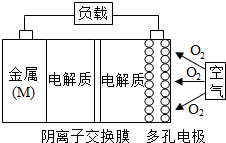 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 比较Mg,Al,Zn三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| C. | M-空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne-=4M(OH)n | |
| D. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
20.大气中CO2含量的增加会加剧“温室效应”.下列活动会导致大气中CO2含量增加的是( )
| A. | 燃烧煤炭供热 | B. | 利用风力发电 | C. | 增加植被面积 | D. | 节约用电用水 |
3.下列生活中的化学的说法,不正确的是( )
| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
20.下列叙述正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | 原子核外各电子层容纳的电子数为2n2个 | |
| C. | 核外电子的分层排布就是核外电子的分层运动 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得电子 |
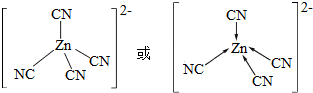 .
.