题目内容
8.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 常温下,1L0.1mol/LNH4NO3溶液中的氮原子数为0.2NA | |
| B. | 常温下,向含1molH2SO4的浓硫酸加入足量的铁粉,转移的电子数为2NA | |
| C. | 标准状况下,2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 将1mol明矾晶体完全溶于水制成胶体,其中所含胶体微粒数目为NA |
分析 A.根据n=nM计算出该溶液中含有硝酸铵的物质的量,然后利用N守恒计算出含有的氮原子数目;
B.常温下铁与浓硫酸发生钝化,阻止了反应的继续进行;
C.标准状况下,己烷的状态不是气体;
D.氢氧化铝胶体为氢氧化铝的聚集体,无法计算含有胶粒数目.
解答 解:A.1L0.1mol/LNH4NO3溶液中含有硝酸铵的物质的量为:0.1mol/L×1L=0.1mol,0.1molNH4NO3中含有0.2molN原子,含有氮原子数为0.2NA,故A正确;
B.常温下Fe与浓硫酸发生了钝化现象,则无法计算转移电子数,故B错误;
C.标准状况下己烷不是气体,不能使用标准状况下的气体摩尔体积计算2.24L己烷的物质的量,故C错误;
D.将1mol明矾晶体完全溶于水制成胶体,由于氢氧化铝胶体为氢氧化铝的聚集体,则无法计算该胶体中含有胶粒数目,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答结构,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.小明去年初中毕业时,收到了表弟通过网购从台湾寄来的高档签字笔和黄铜生肖纪念币,今年表弟即将升入高中,小明决定通过网购回赠表弟一对碳纤维增强的羽毛球铂,这些购物过程中看,涉及到一些常用材料,下列说法不正确的是( )
| A. | 羽毛球拍属于复合材料 | B. | 包装纸箱属于无机材料 | ||
| C. | 塑料笔杆属于高分子材料 | D. | 生肖纪念币属于合金材料 |
13.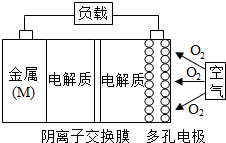 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 比较Mg,Al,Zn三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| C. | M-空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne-=4M(OH)n | |
| D. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
3.下列生活中的化学的说法,不正确的是( )
| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
13.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 14g乙烯与14g苯含有的氢原子数均为2NA | |
| B. | 0.1molFe3+与足量的HI溶液反应,转移的电子数为0.1NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-与H2S数目之和为0.1NA | |
| D. | 6.4g铜溶于30mL10mol•L-1硝酸中,产生气体的分子数为0.2NA |
20.下列叙述正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | 原子核外各电子层容纳的电子数为2n2个 | |
| C. | 核外电子的分层排布就是核外电子的分层运动 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得电子 |
17.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
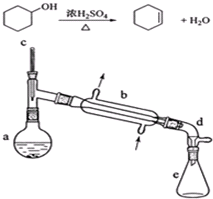
可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为 .
.

可能用到的有关数据如下:
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为
 .
.
18.将两个铂电极用导线连接,放置在NaOH溶液中,然后向两极分别通入甲烷和氧气,下列叙述正确的是( )
| A. | 正极反应式为O2+4e-═2O2- | |
| B. | 放电时溶液中的阳离子向正极方向移动 | |
| C. | 该电池反应为CH4+2O2═CO2+2H2O | |
| D. | 通入CH4一极的电极反应式为CH4+2O2+8e-═CO2+2H2O |
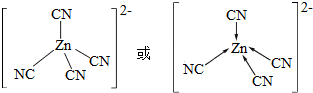 .
.