题目内容
A、B、C、D都是短周期元素,原子半径D>C>A>B.已知:A、B位于同一周期;A、C位于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外电子层上的电子数是D原子最外电子层上的电子数的4倍.试回答:
(1)这四种元素分别是:A ,B ,C ,D
(2)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式: .
(1)这四种元素分别是:A
(2)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为: ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,结合元素对应化合物的性质解答该题.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,结合元素对应化合物的性质解答该题.
 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,结合元素对应化合物的性质解答该题.
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,结合元素对应化合物的性质解答该题.解答:
解:根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为: ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,
(1)由上述分析可知,A为碳元素,B为氧元素,C为硅元素,D为钠元素,故答案为:碳;氧;硅;钠.
(2)A为碳元素,B为氧元素,D为钠元素,A、B、D组成的化合物为Na2CO3,B、C组成的化合物为SiO2,碳酸钠与二氧化硅反应方程式为Na2CO3+SiO2
Na2SiO3+CO2,故答案为:Na2CO3+SiO2
Na2 SiO3+CO2.
 ,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+B,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为D原子最外电子层上的电子数的4倍,故D为钠元素,C为硅元素,A为碳元素,(1)由上述分析可知,A为碳元素,B为氧元素,C为硅元素,D为钠元素,故答案为:碳;氧;硅;钠.
(2)A为碳元素,B为氧元素,D为钠元素,A、B、D组成的化合物为Na2CO3,B、C组成的化合物为SiO2,碳酸钠与二氧化硅反应方程式为Na2CO3+SiO2
| ||
| ||
点评:本题考查元素位置结构性质的关系及推断,题目难度中等,本题的关键是正确推断元素的种类,注意找出其在周期表中的相对位置.

练习册系列答案
相关题目
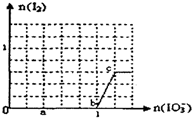 已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO42- |
| B、a点时剩余NaHSO3的物质的量为1.8 mol |
| C、c点时的还原产物可能是KI或NaI |
| D、当溶液中I?与I2的物质的量之比为1:1时,加入的KIO3为1.2mol |
下列叙述正确的是( )
| A、共价化合物一定都是由非金属构成 |
| B、含有共价键的化合物都是共价化合物 |
| C、HCl=H++Cl-,故HCl是离子化合物 |
| D、凡是含有离子键的化合物都是离子化合物 |
