题目内容
下列叙述正确的是( )
| A、共价化合物一定都是由非金属构成 |
| B、含有共价键的化合物都是共价化合物 |
| C、HCl=H++Cl-,故HCl是离子化合物 |
| D、凡是含有离子键的化合物都是离子化合物 |
考点:共价键的形成及共价键的主要类型,离子化合物的结构特征与性质
专题:元素周期律与元素周期表专题
分析:A、共价化合物也可以由非金属和金属构成;
B、含有共价键的化合物可能是共价化合物;
C、HCl中H原子和Cl原子之间只存在共价键,所以为共价化合物;
D、凡是含有离子键的化合物都是离子化合物.
B、含有共价键的化合物可能是共价化合物;
C、HCl中H原子和Cl原子之间只存在共价键,所以为共价化合物;
D、凡是含有离子键的化合物都是离子化合物.
解答:
解:A、共价化合物也可以由非金属和金属构成,如氯化铝是共价化合物,故A错误;
B、含有共价键的化合物可能是共价化合物,也可能是离子化合物,如:过氧化钠中,氧原子和氧原子之间以共价键结合,但过氧化钠是离子化合物,故B错误;
C、HCl=H++Cl-,但HCl是共价化合物,故C错误;
D、凡是含有离子键的化合物都是离子化合物,离子化合物可能含有共价键,故D正确;
故选D.
B、含有共价键的化合物可能是共价化合物,也可能是离子化合物,如:过氧化钠中,氧原子和氧原子之间以共价键结合,但过氧化钠是离子化合物,故B错误;
C、HCl=H++Cl-,但HCl是共价化合物,故C错误;
D、凡是含有离子键的化合物都是离子化合物,离子化合物可能含有共价键,故D正确;
故选D.
点评:本题考查了离子化合物和共价化合物的判断,难度不大,注意:离子化合物中一定含有离子键,可能含有共价键;共价化合物中一定不含离子键.

练习册系列答案
相关题目
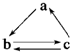 下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | Si | SiO2 | H2SiO3 |
| D | CH2═CH2 | CH3CH2OH | CH3CHO |
| A、A | B、B | C、C | D、D |
为了保护臭氧层,可采取的有效措施是( )
| A、减少二氧化硫的排放 |
| B、减少卤代烃的排放 |
| C、减少废气的含铅量 |
| D、减少二氧化碳的排放 |
核外电子数为1~18的元素中,下列叙述正确的是( )
| A、最外层只有1个电子的元素,一定是金属元素 |
| B、最外层只有2个电子的元素,一定是金属元素 |
| C、原子核外电子层数与最外层电子数相等的元素,一定是金属元素 |
| D、核电荷数为17的元素的原子容易获得1个电子 |
将等物质的量浓度的AlCl3和NaOH两溶液混和,得到的沉淀物中的铝元素与溶液中的铝元素的物质的量相等,则所用AlCl3溶液和NaOH溶液的体积之比可能是( )
| A、1:3 | B、2:3 |
| C、1:4 | D、2:5 |
质量相同的乙烯和一氧化碳具有相同的( )
| A、物质的量 | B、原子个数 |
| C、体积和密度 | D、燃烧产物 |