题目内容
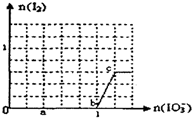 已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO42- |
| B、a点时剩余NaHSO3的物质的量为1.8 mol |
| C、c点时的还原产物可能是KI或NaI |
| D、当溶液中I?与I2的物质的量之比为1:1时,加入的KIO3为1.2mol |
考点:氧化性、还原性强弱的比较,氧化还原反应的计算
专题:氧化还原反应专题
分析:还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,根据发生的反应来判断各个点的产物.
解答:
解:还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,
A、0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,氧化产物为SO42-;继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,氧化产物为I2,故A错误;
B、a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=
×3=1.2mol,则a点时剩余NaHSO3的物质的量为1.8 mol,故B正确;
C、c点时生成I2,发生反应的离子方程式是IO3-+6H++5I-═3H2O+3I2,所以I2是还原产物,故C错误;
D、根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,3mol NaHSO3的溶液消耗KIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为n,则根据反应IO3-+6H++5I-=3H2O+3I2,消耗的KIO3的物质的量为
mol,消耗碘离子的量为
mol,剩余的碘离子为(1-
)mol,当溶液中n(I-):n(I2)=1:1时,即(1-
)mol=nmol,故n=
mol,故加入的n(KIO3)=1mol+
mol=1mol+
mol=
mol,故D错误;
故选:B.
A、0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,氧化产物为SO42-;继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,氧化产物为I2,故A错误;
B、a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=
| 0.4mol |
| 1 |
C、c点时生成I2,发生反应的离子方程式是IO3-+6H++5I-═3H2O+3I2,所以I2是还原产物,故C错误;
D、根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,3mol NaHSO3的溶液消耗KIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为n,则根据反应IO3-+6H++5I-=3H2O+3I2,消耗的KIO3的物质的量为
| n |
| 3 |
| 5n |
| 3 |
| 5n |
| 3 |
| 5n |
| 3 |
| 3 |
| 8 |
| n |
| 3 |
| 1 |
| 8 |
| 9 |
| 8 |
故选:B.
点评:本题考查了离子方程式的有关知识,明确氧化性、还原性前后顺序是解本题关键,结合方程式进行分析解答,易错点是D,根据物质间的反应并结合原子守恒计算,难度中等.

练习册系列答案
相关题目
以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
| A、6mol | B、3mol |
| C、4mol | D、5mol |
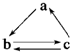 下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | Si | SiO2 | H2SiO3 |
| D | CH2═CH2 | CH3CH2OH | CH3CHO |
| A、A | B、B | C、C | D、D |
2009年5月12日汶川大地震一周年祭奠大会上,胡锦涛主席就灾后重建等相关问题发表了重要讲话.灾后重建需要大量钢材和金属合金材料,下列说法正确的是( )
| A、铁和钢材的主要化学成分相同,性质也相同 |
| B、硬铝(Al-Cu-Mg-Mn-Si合金)制成的门窗耐酸、耐碱、耐高温腐蚀 |
| C、黄铜矿(CuFeS2)可冶炼出Cu、Fe,同时可制取硫酸 |
| D、铁矿石是一种可再生资源,没有必要进行开采限制 |
同温同压下,A容器的氯气(Cl2)和B容器的氨气(NH3)中,若它们所含的原子数相等,则这两个容器的体积之比是( )
| A、2:1 | B、2:3 |
| C、1:4 | D、1:2 |
为了保护臭氧层,可采取的有效措施是( )
| A、减少二氧化硫的排放 |
| B、减少卤代烃的排放 |
| C、减少废气的含铅量 |
| D、减少二氧化碳的排放 |
核外电子数为1~18的元素中,下列叙述正确的是( )
| A、最外层只有1个电子的元素,一定是金属元素 |
| B、最外层只有2个电子的元素,一定是金属元素 |
| C、原子核外电子层数与最外层电子数相等的元素,一定是金属元素 |
| D、核电荷数为17的元素的原子容易获得1个电子 |